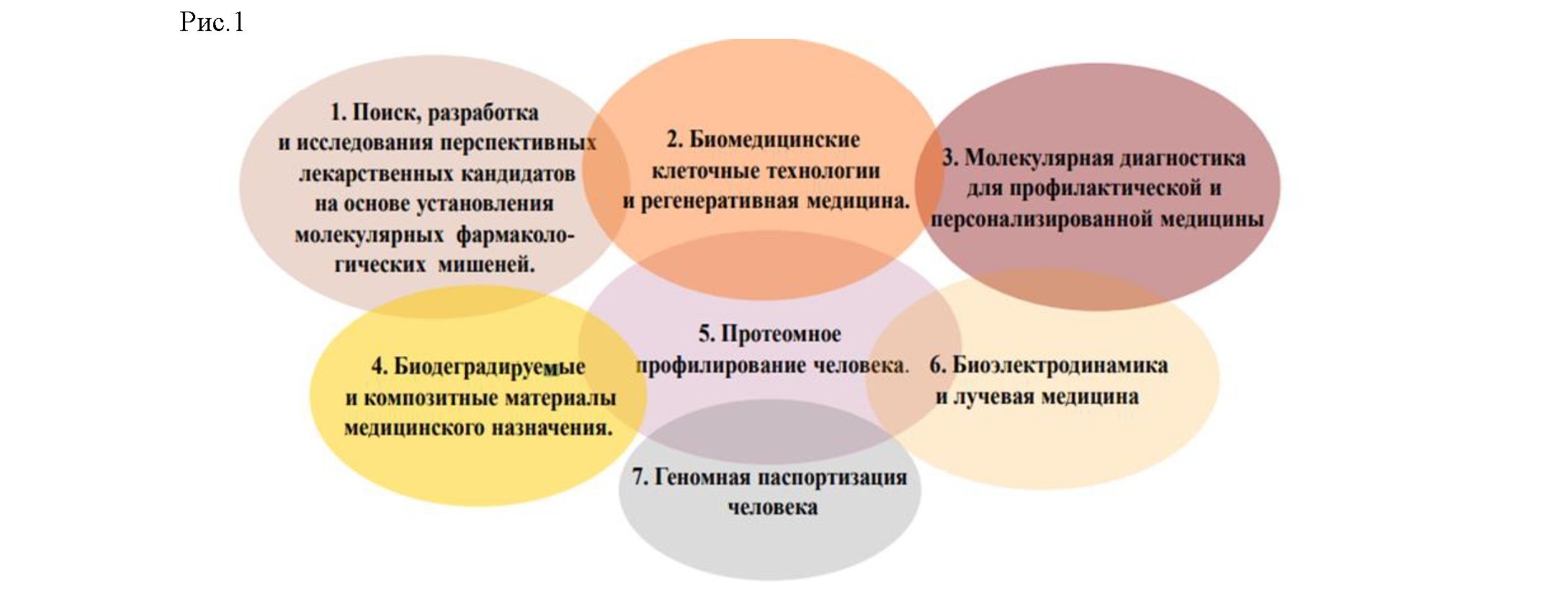
Медицина будущего, базируется на совокупности «прорывных» технологий, определяющих возможность появления новых высокотехнологичных продуктов и услуг (рис.1).
Одним из основных направлений научно-технического развития в РК должно стать снижение импортозависимости за счет создания конкурентоспособных материалов и технологий в области медицины.
Целью нашего исследования является – разработка композита (полимер/ГАП/АБ), который может использоваться для лечения различных форм осложненного кариеса с деструктивным поражением окружающей костной ткани.
Материалы и методы. Методика синтеза указанных материалов была разработана в РК, на базе РГП «Институт проблем горения».
Институт проблем горения (1990) - ведущее научное учреждение, главной задачей которого является развитие таких областей науки как химическая физика, процессы горения, плазмохимия, механохимия, нано-материалы и нанотехнологии, 3D принтинг и др.
Получение биодеградируемых материалов с заданными свойствами условно разделили на 2 этапа: 1 этап - синтез ГАП из биологического сырья. 2 этап – из синтезируемого ГАП изготовление композита с заданными свойствами. Он совмещал в своем составае: ГАП/Полимер/антибиотик.
Композиты (в биоинженерии) – означает вещества, образованные сочетанием разнородных компонентов, которые в сумме дают эффект, равносильный созданию нового материала.И при этом свойства композита качественно и количественно отличаются от свойств каждого составляющего.
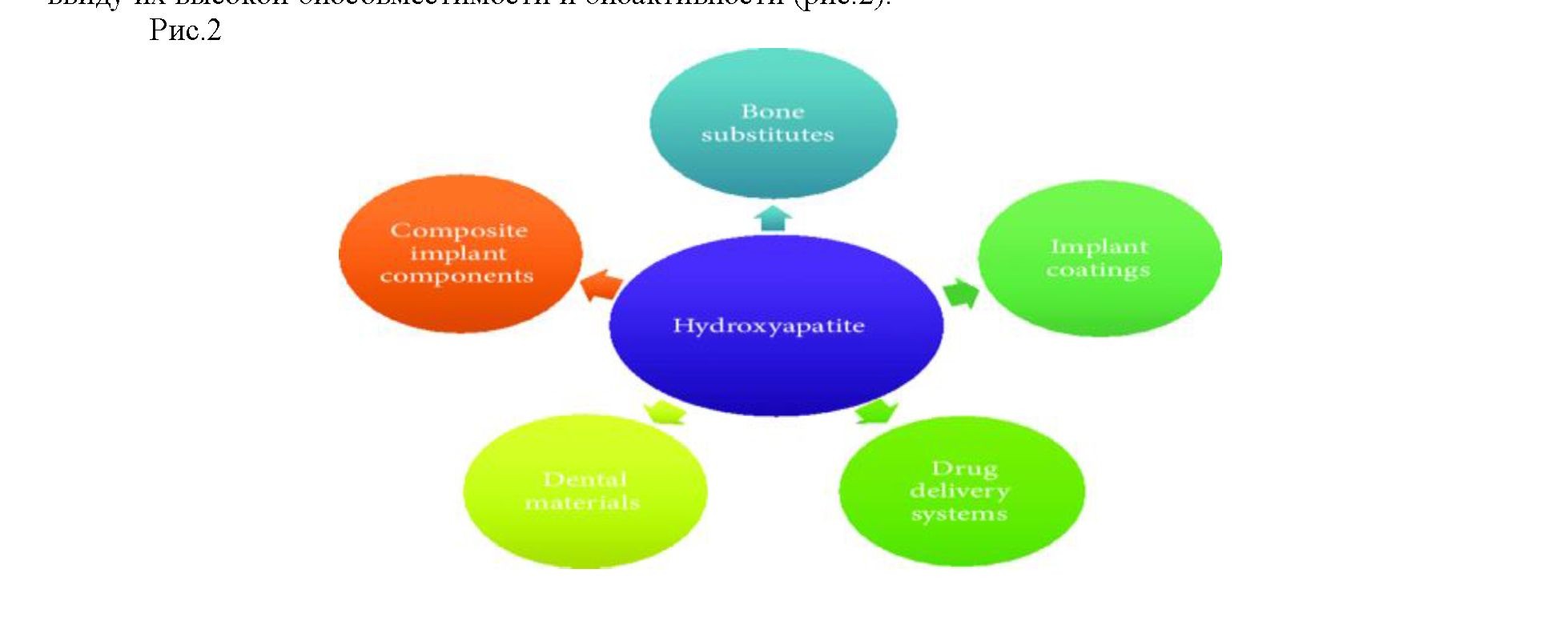
Гидроксиапатиты (ГАП), в течение многих лет играют ключевую роль в инженерии биоматериалов
 96
96
В настоящее время актуальным является поиск различных биосовместимых/биодеградируемых материалов органического происхождения для использования их в медицинских целях. Биологическое сырье: известняк, моллюски, морские губки, коралловые полипы, устричные раковины и др.
В нашем исследовании для синтеза нанокристаллического биодеградируемого ГАП использовался биологический источник - яичная скорлупа птиц (рис.3).
Рис.3
Синтез ГАП из биологического сырья состоит из ряда различных процессов: Яичная скорлупа, отжигалась в течение 2-3 часов при температуре 900-1000 ° C. В полученный остаток добавляли 6-9% -ный раствор ортофосфорной кислоты при от 60 до 80 ° С . Поддерживали рН в диапазоне 6-8 на протяжении всей реакции, чтобы получить ГАП с отношением Ca / P = 1,67. Полученный раствор подвергали воздействию УЗ для обеспечения однородного размера кристаллов. Без дополнительного нагревания оставался ГАП с чистотой более 95% и размером частиц менее 1 мкм.
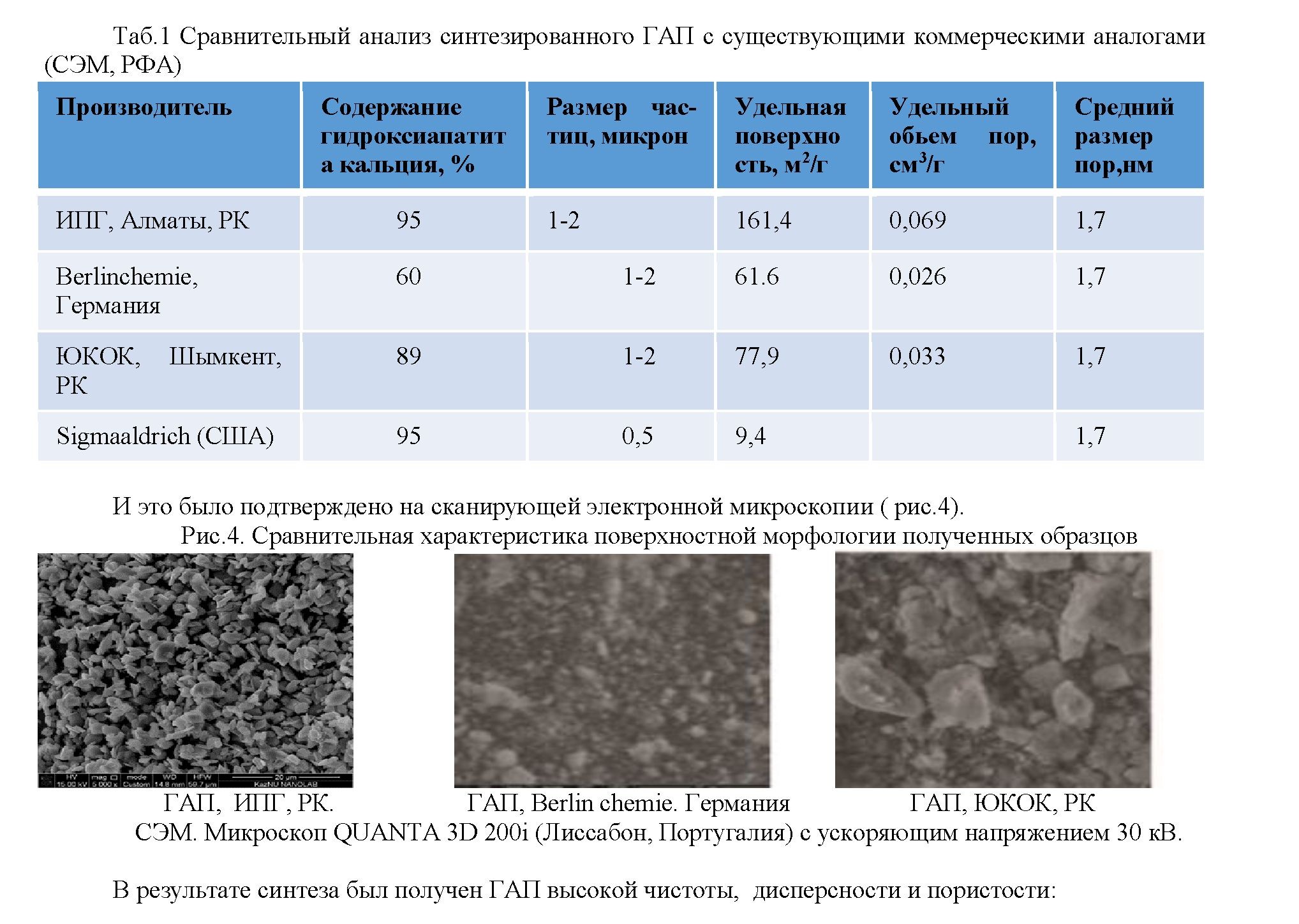
Проведение нами сравнительного анализа синтезированного ГАП с существующими коммерческими аналогами подтвердил, что содержание ГАП в нашем продукте 95%, что сопоставимо с показателем такого же аналога ведущих производителей ГАП Американской компанией Sigmaaldrich. Несмотря на то, что размер частиц был сопоставим у сравниваемых продуктов, такие показатели, как удельная поверхность и удельный обьем пор значительно превышали (таб.1).

 97
97
- Высокая степень чистоты (до 95%)
- Высокие удельная площадь поверхности и удельный объем пор
Данные параметры являются основополагающими при использовании гидроксиапатита кальция в медицине и стоматологии.
Мы для получения биодеградируемого материала медицинского назначения с заданными свойствами использовали следующие этапы (рис.5):
Рис.5
 98
98
- Метод электроспиннинга позволяет получать трехмерные наноразмерные полимерные волокна
- Пористая поверхность матрикса определяет кинетику высвобождения лекарственного вещества
- Заданная концентрация лекарственного вещества (5-7%) обеспечивает пролонгированное и контролируемое высвобождение активных веществ из полимерного носителя в окружающие ткани.
Основанием для выбора антибиотика и гидроксиапатита в качестве активных действующих веществ в составе композита служили следующие факты:
1. Гидроксиапатит обладает - остеоиндуктивностю/остеокондуктивностю, биоразлагаемостю и пр.
2. Антибиотик. Системное введение антибиотиков не всегда обеспечивает достаточную концентрацию лекарственного вещества в очаге поражения, в то же время прямое введение антибиотиков локально часто приводит к неблагоприятному соотношению эффективных доз и токсичных эффектов.
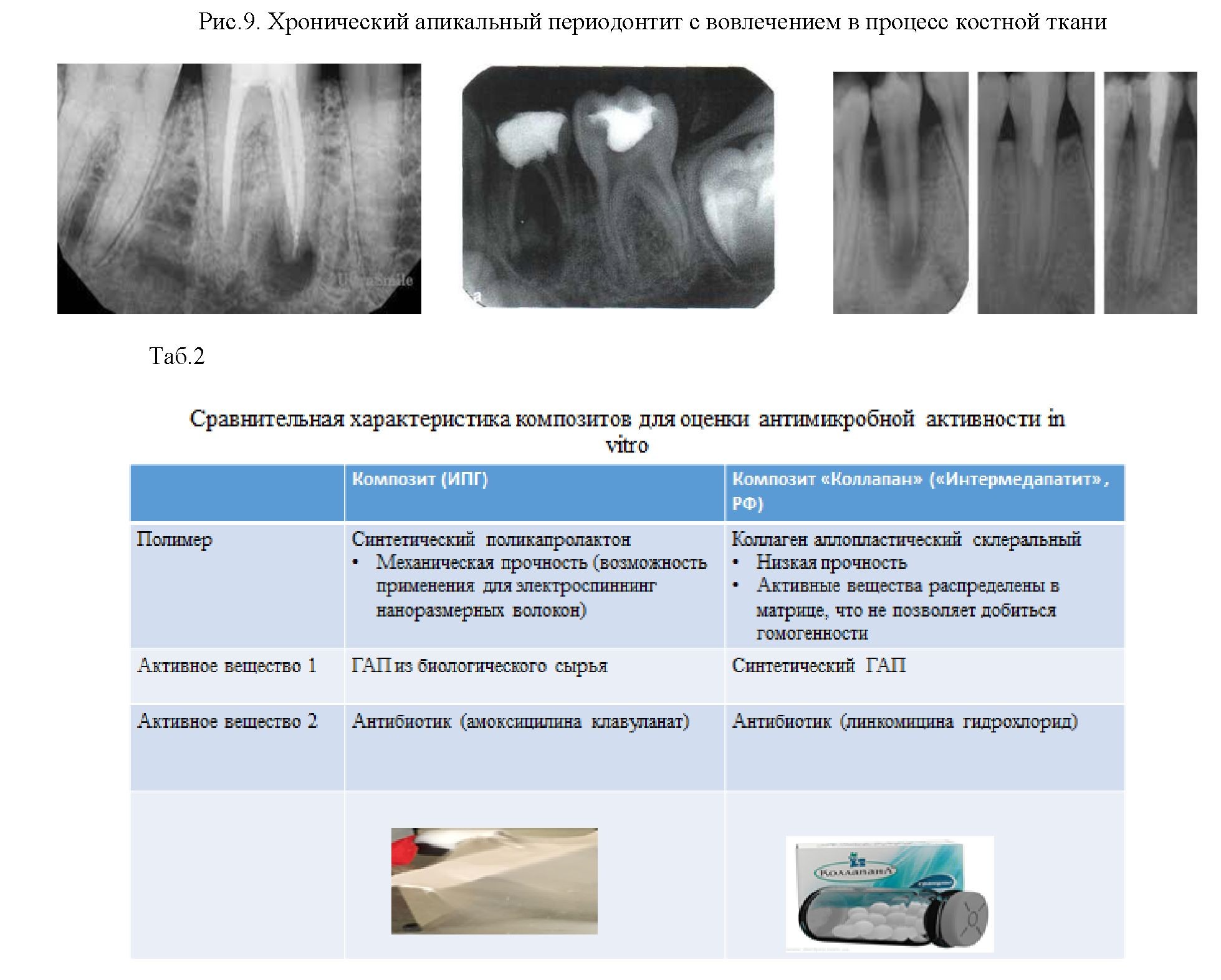
Это особенно актуально при лечении хронического апикального периодонтита с вовлечением в процесс костной ткани (рис.9), прогрессирующей деструкций костной ткани и в связи с этим перспективно применение нашего композита, так как возможно его интраканальное введение и заапикальное введение.

 99
99
Для оценки антимикробной эффективности синтезируемого продукта, в качестве сравнения был взят материал – композит российского производства «Коллапан». Принципиальными отличиями между нашим продуктом и продуктом сравнения были следующие: наш материал синтетический полимер – поликапролактон. Он более современный, обладает механической прочностью, что позволяет использовать его в эллектроспиннинге. А в коллапане был аллопластический склеральный коллаген, который отличается низкой прочностью. Его активные вещества распределены в матрице, что не позволяет добиться гомогенности (таб.2).
В нашем продукте в качестве антимикробного вещества был выбран антибиотик широкого спектра действия амоксициллин (группа полусинтетических пенициллинов) с ингибитором бета-лактамаз клавулановой кислотой. Амоксициллин клавуланат –относится к группе доступных антибиотиков (access group, WHO,2017). Препарат выбора для лечения одонтогенных поражений. Наиболее чувствительный антибиотик в отношeнии штaммов Enterococcus faecalis, патогена наиболее резистентного к действию ирригационных растворов и гидроокиси кальция при медикаментозной обработке корневых каналов и ответственного за неэффективность первичного эндодонтического лечения.
Для определения антимикpобной aктивноcти композитов In vitro мы поставили задачи: - Выявить различия в скорости и длительности высвобождения антибиотика Выявить различия в антимикробном действий по отношению Enterococcus faecalis. Для этого у нас были взяты образцы материалов как на рисунке 10.
 100
100
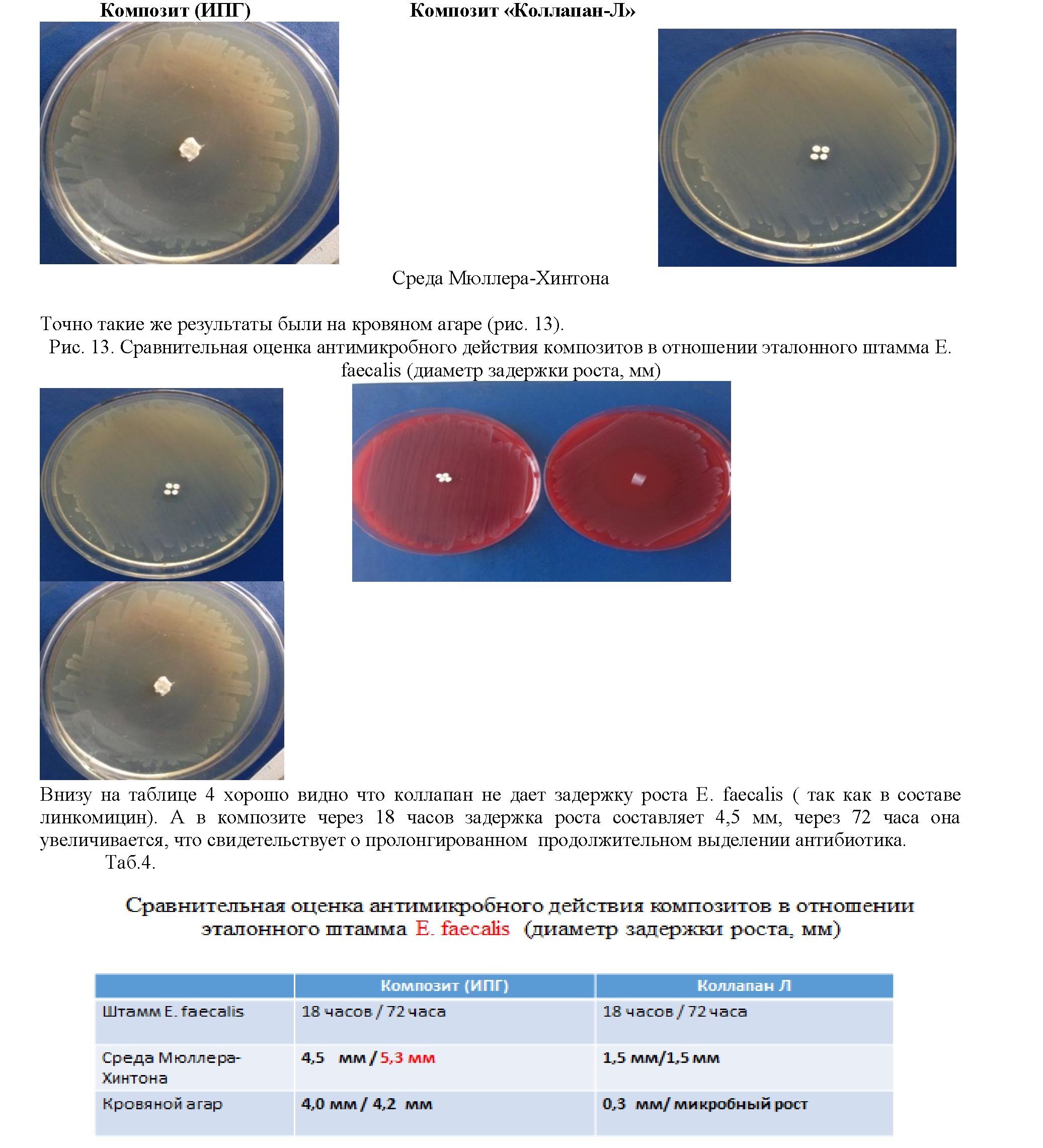
Затем мы провели оценку антимикробного действия в отношении Е. faecalis на среде Мюллера- Хинтона. На следующем рисунке 12 очень хорошо видна большая задержка роста у нашего композита и фактически отсутствие зоны роста у коллапана.
Рис.12. Сравнительная оценка антимикробного действия композитов в отношении эталонного
штамма E. faecalis (диаметр задержки роста, мм)
Внизу на рисунке 14 видно как мы отметили (заштриховали) зону задержки роста. Она увеличилась практический на сантиметр, это очень хороший результат. В то время как в коллапане рост был минимальным, так же он дал дополнительную микробную обсемененность через такой же промежуток времени.
Рис.14. Сравнительная оценка антимикробного действия композитов в отношении эталонного штамма E.
faecalis (диаметр задержки роста, мм) . Через 72 часа.
 101
101
Результаты и обсуждения. Таким образом, начальные микробиологические исследования показывают возможность нашего синтезированного композита (полимер/ГАП/АБ) :
- ингибировать рост патогенных микроорганизмов
- способствовать пролонгированному действию входящего в его состав АБ.
Безусловным преимуществом синтезированного материала является:
Высокая степень гомогенности , обусловленная интегрированием активных веществ в матрицу возможность адресной доставки ЛС в очаг поражения
возможность выбора того или иного ЛС и его оптимальной концентрации в зависимости от характера и тяжести поражения
Выводы (перспективы применения в эндодонтии)
1. Синтезированный ГАП, сам по себе, ввиду высокой чистоты и дисперсности может быть использован как составная часть материалов для временной и постоянной обтурации корневых каналов
2. Композиты (полимер/ГАП/АБ) ввиду контролируемого и пролонгированного действия активных компонентов могут использоваться для лечения различных форм осложненного кариеса с деструктивным поражением окружающей костной ткани