Проведены молекулярно-генетические исследования у больных с болезнью Паркинсона (БП) и сосудистым паркинсонизмом (СП) узбекской национальности. Исследована ассоциация различных генотипов полиморфизма С282Т гена Nаt2 с паркинсонизмом. Выявлены достоверные различия в частоте встречаемости генотипа m/m между основной и контрольной группами (χ2= 4,9; p= 0,02).Гомозиготность по мутантным аллелям полиморфизма С282Т гена NAT2 была достоверно ассоциирована с повышенным риском развития БП, развития акинетико-ригидной формы и быстрых темпов прогрессирования.
Ключевые слова: паркинсонизм, болезнь Паркинсона, ген Nаt2
Болезнь Паркинсона относится к группе мультифакториальных заболеваний, которые представляют собой самую многочисленную и разнообразную группу болезней, составляющую более 90% от всей соматопатологии человека и характеризующуюся наиболее высокими темпами роста заболеваемости, смертности и инвалидизации трудоспособного населения в современных популяциях [1, 2].
За последнее десятилетие приложены огромные усилия по изучению этиологии и патогенеза болезни Паркинсона. Многочисленными зарубежными и отечественными исследованиями было показано, что в основе развития БП лежат сложные взаимодействия генетических и средовых факторов [3].
С развитием молекулярно-генетических технологий открылись широкие возможности для формализации генетической компоненты подверженности БП, накоплено значительное число данных о вовлеченности различных полиморфных генов в формирование предрасположенности к БП [4, 5]. Однако, несмотря на достигнутые успехи мирового научного сообщества в области изучения генома человека и в разработке высокоразрешающих методов анализа ДНК, по-прежнему, известно относительно небольшое число генов, которые в совокупности только частично объясняют некоторые звенья патогенеза БП [4, 6, 7].
Многие работы свидетельствуют о влиянии полиморфизма ацетилирования NAT2 на развитие различных заболеваний, в том числе некоторых неврологических, в частности болезни Паркинсона [6]. В одном из исследований [7] cообщается о повышении частоты полиморфизма «медленных ацетиляторов» в группе БП по сравнению с контрольной группой в Великобритании, однако эта закономерность не была подтверждена после введения поправки на множественные сравнения. Эти результаты подтолкнули нас к дальнейшему исследованию ассоциаций с БП полиморфных вариантов Nаt2 в качестве маркера повышенного риска развития заболевания.
Мы поставили перед собой цель по поиску ассоциаций полиморфизма С282Т гена Nаt2Т с болезнью Паркинсона у лиц узбекской национальности, а также при обнаружении данной связи, проведение гено-фенотипических ассоциаций.
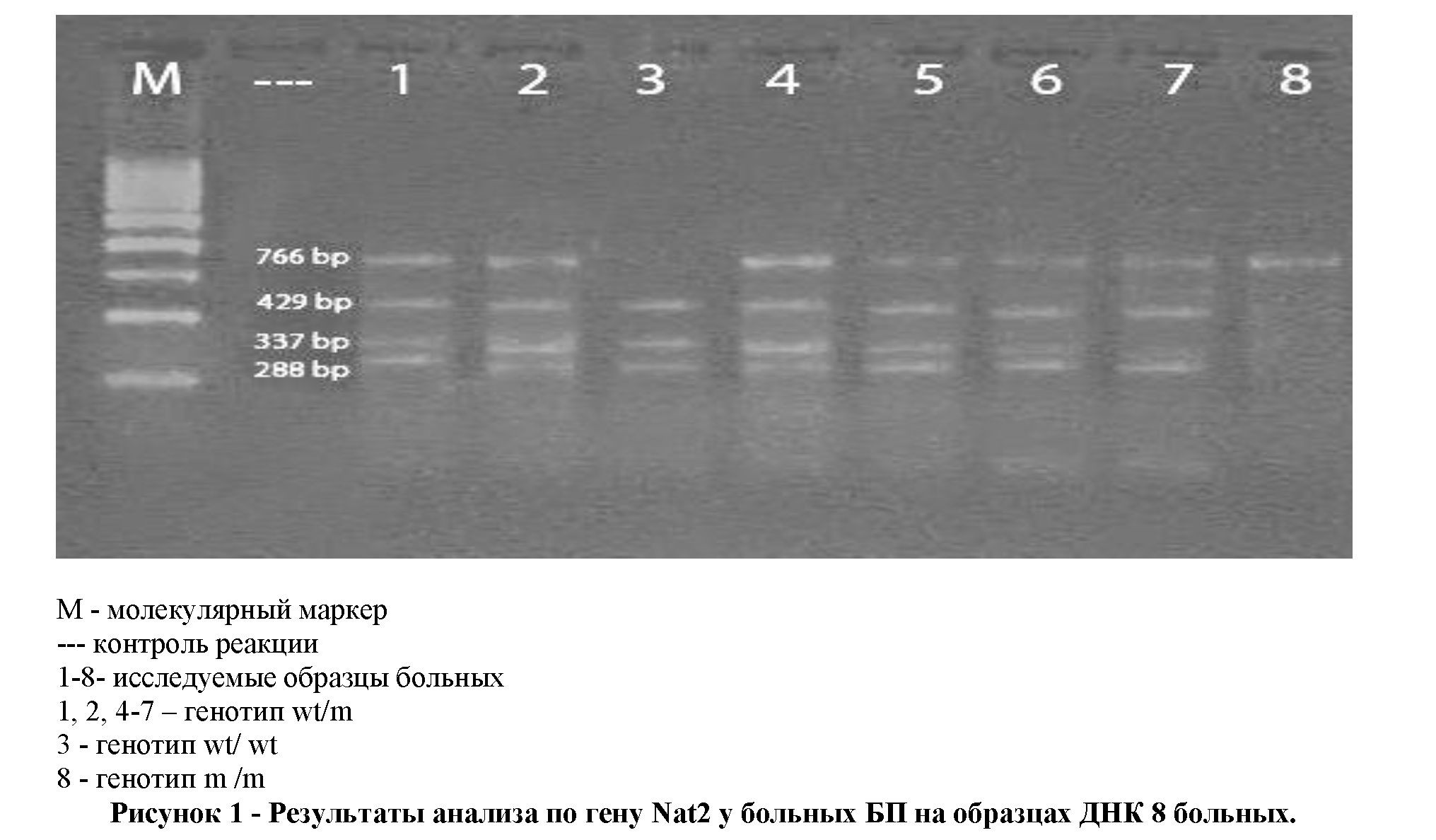
Материал и методы исследования: Молекулярно-генетические исследования проведены на образцах ДНК 280 человек, из них с болезнью Паркинсона было 140 больных, больные сосудистым паркинсонизмом составили 60 человек и 80 человек составили группу контроля. Все обследованные лица были лицами узбекской национальности по обеим родительским линиям и происходили из семей, проживавших на протяжении 3 поколений на территории Узбекистана.
Молекулярно-генетические исследования проводились в Центре геномных технологий (ЦГТ) при Институте Генетики и Экспериментальной Биологии Растений (ИГиЭБР) Академии Наук Республики Узбекистан (АН РУз) и Центре Медицинской Генетики Института Биохимии АН РУз (директор проф. Р.С. Мухамедов).
Материалом для ДНК служила венозная кровь из локтевой вены объемом 1 мл. Для сбора, хранения и транспортировки крови использовались вакьютейнеры или одноразовые пластиковые пробирки с антикоагулянтом (консерватором) объемом 0,5 мл. Кровь для дальнейшей обработки хранилась при температуре не менее +4 °С.
Выделение ДНК из цельной крови осуществлялось набором реагентов Diatom™ DNA Prep 200 (производство ООО “Лаборатория ИзоГен”, Москва, Россия). Выделение ДНК проводилось по стандартному протоколу выделения ДНК с использованием набора реагентов Diatom™ DNA Prep 200.
Супернатант с ДНК далее подвергался непосредственно генотипированию путем ПЦР- амплификации.
ПЦР анализ проводили с использованием набора реагентов для ПЦР амплификации ДНК GenePak™ PCR Core (производство ООО “Лаборатория ИзоГен”, Москва, Россия).Использовались готовые для амплификации пробирки MasterMix, которые содержат в лиофилизированном сухом состоянии ингибированную “для горячего старта” Taq ДНК полимеразу,
дезоксинуклеозодтрифосфаты и хлорид магния с конечными концентрациями, соответственно, 1 u, 200 мкМ и 2,5 mM, а также опримизированную буферную систему для проведения стандартной ПЦР амплификации. В пробирки MasterMix добавлялось по 5 мкл смеси праймеров, с конечной концентрацией 0.5 мкМ, 10 мкл ПЦР растворителя и по 5 мкл исследуемой ДНК.
Типирование образцов ДНК по гену Nat2 проводили с праймерами 5' gga-aca-aat-tgg-act-tgg 3' (F) и 5' tct-agc-atg-aat-cac-tct-gc 3' (R).
Так как анализируемая нами мутация представляет собой точечную нуклеотидную замену, для её верификации использован ПДРФ-анализ – анализ полиморфизма длины рестрикционных фрагментов (RestrictionFragmentLengthPolymorphism - RFLP analysis). Для анализа выбранной нами мутации нами использована рестриктазаFok1.
ПЦР-продукты амплификации фракционировали в 2-3 % агарозном геле в течение 60-90 мин при напряжении 100-120 В, окрашивали бромистым этидием и визуализировали в УФ-свете
Статистическую обработку полученных результатов проводили с помощью стандартных методов вариационной статистики с применением t-критерия Стьюдента для оценки достоверности различий с использованием программы Excel – 2007 и BioStat 2007. Средние величины представлены в виде Мm (средняя величинасредняя ошибка средней). Основой статистической обработки был Х2-анализ четырехпольных таблиц распределения генотипов в изучаемой группе и контроле. В качестве порога уровня значимости был выбран стандартный уровень Р=0,05 (5%). Для каждого генотипа вычисляли отношение шансов ОR, характеризующее риск заболевания, и соответствующий 95% доверительный интервал.
Результаты исследования и их обсуждение:
При проведении молекулярно-генетического исследования по поиску мутации С282Т гена Nat2 гомозиготы по мутантным аллелям выявлены в группе больных с паркинсонизмом в 15% случаев (30 больных), что достоверно (при р<0,05) больше, чем в группе контроля, в которой данная мутация отмечена в 6,25% случаев (5 больных). Изучение показателя отношение шансов (OR) показало, что OR>1, т.е. при мутации С282Т гена Nat2 - OR=2,8 (95% ДИ от 1,01 до 8,7) и, что шансы развития паркинсонизма у лиц с мутацией С282Т гена Nat2 увеличены в 2,8 раза (табл. 1.).
Таблица 1 - Распределение генотипов гена NAT2 в группе больных паркинсонизмом и контрольной выборке
|
Генотип |
Контроль (n=80) |
Больные (n=200) |
2 |
р |
ОR |
||
|
n |
% |
n |
% |
||||
|
Wt/wt |
45 |
56,25 |
78 |
39 |
6,2 |
0,01 |
0,49 (0,280,87) |
|
Wt/m |
30 |
37,5 |
92 |
46 |
1,35 |
0,24 |
1,4 (0,8-2,5) |
|
m/m |
5 |
6,25 |
30 |
15 |
3,9 |
0,02 |
2,8 (1,01-8,7) |
Примечание: wt – аллель дикого типа, m – аллель мутантного типа,2 - распределение Пирсона (хи– квадрат);р - уровень значимости; OR - отношение шансов, полужирным шрифтом отмечены достоверные показатели и высокие показатели отношения шансов
При сравнительном анализе частот генотипов гена Nat2между выборками больных паркинсонизмом и контрольной группой, нам удалось получить статистически достоверные отличия в случае распределения генотипа wt/wt(р=0,01, 2=6,2), при ОR=0,49, что указывает на то, что аллель дикого типа не ассоциирована с развитием БП.Из таблицы видно, что наблюдается количественное
преобладание генотипа wt/m в группе с паркинсонизмом (46%) по сравнению с контрольной группой (37,5%), однако, достоверных различий между группами не установлено (р=0,24).
Генотипы, в составе которых имеется аллель дикого типа, ассоциированы в основном с фенотипом быстрого ацетилятора, а гомозиготы по мутантным аллелям - с фенотипом медленного ацетилятора.
Также мы исследовали частоту встречаемости различных генотипов полиморфизма С282Т гена Nat2 в зависимости от клинической формы паркинсонизма. В результате проведенного анализа выявлены достоверные различия в частоте встречаемости генотипа m/m у больных с БП (17,98%) по сравнению с контрольной группой (6,25%) (2=4,9, p=0.02). Значение OR=3.26 показывает повышенный риск развития заболевания при носительстве данной мутации. При анализе распределения генотипа wt/wt выявлено, что «дикий» генотип достоверно чаще встречался у контрольной группы (56,25%) пациентов по сравнению с группой БП (32,1%) (2 = 11.2, р = 0.001). Значение OR = 0,37 свидетельствует об ассоциации данного генотипа с устойчивостью к развитию БП. В группе больных с СП частота встречаемости различных генотипов полиморфизма С282Т гена Nat2 не имела статистически значимых различий с группой контроля; однако с группой БП имела достоверные различия по генотипу wt/wt, при значении OR=0,39 (табл.2.).
|
Генотип |
Контроль (n=80) |
Больные БП (n=140) |
Больные СП (n=60) |
Р1 |
Р2 |
Р3 |
|||
|
n |
% |
n |
% |
N |
% |
||||
|
Wt/wt |
45 |
56,25 |
45 |
32,1 |
33 |
55 |
0,001 |
0,1 |
0,005 |
|
Wt/m |
30 |
37,5 |
70 |
50 |
22 |
36,7 |
0,09 |
0,1 |
0,1 |
|
m/m |
5 |
6,25 |
25 |
17,9 |
5 |
8,3 |
0,02 |
0,9 |
0,13 |
Таблица 2 - Распределение генотипов гена NAT2 в зависимости от клинической формы паркинсонизма
Примечание: wt – аллель дикого типа, m – аллель мутантного типа, Р1 – достоверность различий между группой контроля и больными с БП, Р2- достоверность различий между группой контроля и больными с СП, Р3- достоверность различий между больными с БП и СП, полужирным шрифтом отмечены достоверные показатели.
2 1
Мы изучили ассоциацию между генотипомm/m и различными клиническими признаками болезни Паркинсона. При этом были выявлены две из них: ассоциация с вариантом заболевания и скоростью прогрессирования. Данный генотип был ассоциирован с акинетико-ригидной формой заболевания (60% случаев) и быстрыми темпами прогрессирования (48% случаев).
Таким образом, на основании результатов исследования можно сделать заключение, что при болезни Паркинсона у лиц узбекской национальности наблюдается повышение частоты генотипа 0/0 гена GSTM1 и генотипа 0/0 гена GSTТ1, а также их комбинаций, с достоверно более ранним дебютом и быстрыми темпами прогрессирования заболевания, преобладанием развернутой- смешанной формы в группе больных с «нулевыми» генотипами по сравнению с больными без мутаций в этих генах.
Гомозиготность по мутантномуаллелю полиморфизма гена NAT2 ассоциирована с БП в целом, а также с его акинетико-ригидной формой и быстрыми темпами прогрессирования.
Литература
- Бойко А.Н., Петров С.В. Регистр больных болезнью Паркинсона. //Болезни движений: медицинские и социальные аспекты-Москва-2010.-С. 297-302.
- Угрюмов М.В./Болезнь Паркинсона: Новые представления о патогенезе, диагностике и лечении.// Болезни движений: медицинские и социальные аспекты-Москва-2010.-С. 61-67.
- Багыева Г.Х. /Клинико-генетический и биохимический анализ болезни Паркинсона: Механизмы предрасположенности, экспериментальные модели, подходы к терапии//Автореф. дис. докт. мед.наук.-Москва-2009.-48с.
- Джурич Г., Иллариошкин С.Н., Светел М. и др. Влияние комбинированных полиморфизмов в генах CYP2D6, PON1 и apoE на риск развития болезни Паркинсона// Сборник I Национального конгресса по болезни Паркинсона и расстройствам движений.- Москва.-2008 г.-стр. 357.
- Мизуно Й./Механизмы развития и прогрессирования болезни Паркинсона// Болезни движений: медицинские и социальные аспекты-Москва-2010.-С. 49-56.
- Chan D.K.Y., MD,. Lam M.K.P, PhD; Wong R. et al. Strong association between N- acetyltransferase 2 genotype and PD in Hong Kong Chinese// Neurology.- 2003.-Vol.60.-P.1002–1005
- Klein, C., Schlossmacher, M. G. Parkinson disease, 10 years after its genetic revolution: Multiple clues to a complex disorder. Neurology.-2007.- 69: 2093-2104