Лекарственные средства являются особым видом продукции. К ним предъявляются высокие требования по безопасности и эффективности, обеспечиваемые на всех этапах разработки, испытаний, производства и реализации. Обеспечение качества является комплексной задачей, в которую входят:
- использование материалов, отвечающих заданным требованиям;
- производство продукции в помещениях и на оборудовании, гарантирующих выпуск продукции в соответствии с заданными требованиями;
- введение требований международных стандартов GMP на производстве;
- соответствие персонала требованиям к профессиональной подготовке, личной гигиене, исполнительности и добросовестности.
Одним из фундаментальных элементов обеспечения качества процесса производства является свод правил о надлежащей производственной практике GMP (Good manufacturing practice — GMP) лекарственных средств. [1-2] В определении, которое дано GMP Всемирной организацией здравоохранения, придается особое значение принципу создания контроля качества во время производства, который направлен на обеспечение высокого уровня качества и безопасности лекарственных средств и гарантирование того, что лекарственное средство изготовлено в соответствии со своей формулой (составом), не содержит посторонних включений, маркировано надлежащим образом, упаковано и сохраняет свои свойства в течение всего срока годности [2, 4].
Производитель лекарственных средств должен организовать контроль качества и производство так, чтобы лекарственные средства гарантированно соответствовали своему назначению и предъявляемым к ним требованиям и не создавали риска для потребителей из-за нарушения условий безопасности, качества или эффективности. Ответственность за выполнение этих требований несут руководители и все работники предприятия- производителя. Для достижения этой цели на предприятии на основе настоящего стандарта (Правил GMP) должна быть создана система обеспечения качества, включающая в себя организацию контроля качества.
В связи с этим, для того, чтобы при производстве лекарственных препаратов строго выполнялись все нормативные требования, разработана и организована система управления качества. Служба качества на предприятии представлена отделом обеспечения качества и отделом контроля качества.[3-4] Обеспечение качества является комплексной задачей, решение которой требует реализации всех мер, направленных на достижение заданных требований к качеству лекарственных средств. Обеспечение качества основывается на выполнении требований настоящего ста нда рта и других нормативных документов.
Система обеспечения качества (система качества) при производстве лекарственных средств должна гарантировать следующее:
- Лекарственные средства разработаны с учетом требований стандарта и требований работе лабораторий.
- На все производственные и контрольные операции разработана документация в соответствии с настоящим стандартом.
- Ответственность и обязанности всех работников четко определены.
- Предусмотрены меры, обеспечивающие производство, поставку и использование исходных и упаковочных материалов, соответствующих заданным требованиям.
- Контроль промежуточной продукции и технологического процесса (внутрипроизводственный контроль).
- Аттестация (валидация) процессов и оборудования проводятся в необходимом объеме.
- Производство и контроль готовой продукции соответствуют утвержденным инструкциям (методикам).
- Уполномоченное лицо должно подтвердить, что каждая серия продукции произведена и проверена в соответствии с установленными требованиями.
- Существующая система мер обеспечивает уровень качества лекарственных средств при их хранении, отгрузке и последующем обращении в течение всего срока годности.
- Порядок проведения самоинспекции и/или аудита качества позволяет регулярно оценивать эффективность системы обеспечения качества. Правильно составленная документация является важной частью системы обеспечения качества. Точная, полная, актуальная документация предотвращает ошибки, возникающие вследствие устного общения, неправильного толкования слов, неполной или утерянной информации, обеспечивает постоянную воспроизводимость серии.
Промышленное производство лекарств регламентируется соответствующей нормативно-технической документацией (НТД), утвержденной в установленном порядке.
НТД должна обеспечивать повышение качества и эффективности лекарственных препаратов, постоянно совершенствоваться на основе достижений науки и техники и своевременно пересматриваться с целью замены устаревших показателей в соответствии с потребностями здравоохранения, населения, обороны страны и экспорта.
ПРИМЕР СХЕМЫ КЛАССИФИКАЦИИ ДОКУМЕНТАЦИИ

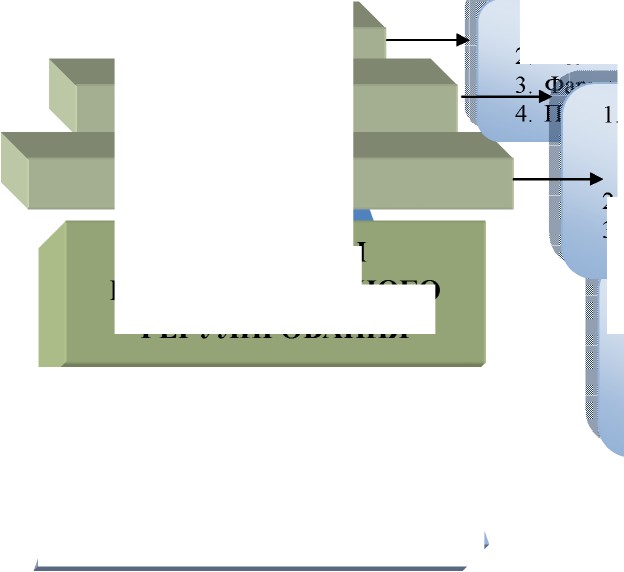

1. Информация о предприятии;
2. Политика в области качества;
1 ХІІЛЛІЛ.'ІІІ
2 УРОВЕНЬ
2.
3.
ДОКУМЕНЫ
ГОСУДАРСТВЕННОГО
РЕГУЛИРОВАНИЯ
Стандарт предприятия или стандартные операционные процедуры (СОП); Спецификации;
Заполняемые формы документов;
- Досье на серию;
- Отчеты;
- Заполняемые формы производства;
- Досье на продукт;
- Паспорта, протоколы
- Структура организационно-технологической документации
В таблице приведены виды организационно-технологических документов. Таблица 1 - Виды организационно-технологических документов
|
Наименование документа |
Назначение |
|
Информация о предприятии, регистрационное досье, лицензия на производство и пр. |
Общая документация предприятия |
|
Спецификация |
Документ, содержащий требования к материалам или продукции |
|
Промышленный регламент, технологическая инструкция, инструкция по упаковке |
Документы, устанавливающие требования к процессам производства конкретной продукции |
|
Инструкция (методика) |
Документ, устанавливающий требования, общие для производств различных видов продукции |
|
Протокол на серию |
Документ, отражающий фактические данные о производстве конкретной серии продукции |
|
Внутрипроизводственная этикетка |
Документ, идентифицирующий материалы или продукцию, содержащие указание их статуса в производстве |
Технологическая документация должна быть составной частью документации системы контроля качества предприятия. К документации по контролю качества относят:
- спецификации на исходное сырье и готовую продукцию;
- методики отбора проб;
- методики и протоколы проведения испытаний (в т.ч. аналитические операционные листы и/или лабораторные журналы);
- аналитические отчеты и/или паспорта;
- результаты контроля окружающей среды в производственных помещениях;
- протоколы аттестации (испытаний) аналитических методов.
При составлении технологической документации должны учитываться результаты валидации технологических процессов.[3-4] Валидация (аттестация, испытания) направлена на повышение эффективности работы. Валидацию проводят:
- при утверждении нового регламента производства или метода производства;
- при существенных изменениях технологии, в т.ч. любых изменениях оборудования или материалов, способных влиять на качество продукции или воспроизводимость процесса;
- для постоянного подтверждения достижения требуемых результатов.
Каждое фармпроизводство имеет свои отличительные особенности. Это связано с выпускаемой номенклатурой лекарственных препаратов, особенностью проекта производства, Устава предприятия, его структуры, специфических особенностей выпускаемой продукции.
Фармацевтическое предприятие должно иметь 10 основных стандартов предприятия, соответствующих всем разделам GMP: J управление качеством,
J персонал,
•J помещения и оборудование,
•J технологическая документация,
J производство,
•J контроль качества,
•J контракты на производство продукции и выполнение анализов,
J рекламации и отзыв продукции,
•J валидация,
•J самоинспекция.
Особенности производства различных лекарственных средств содержатся в специфических требованиях Правил GMP и должны учитываться в основных стандартах предприятия. На базе 10 основных стандартов фармпредприятия пишутся положения о структурных подразделениях, которые в свою очередь дают материал для написания должностных инструкций, а технологический регламент - рабочих инструкций и методик анализов.[2-3] Все это позволяет написать Досье предприятия, необходимое для лицензирования, формат которого предложен в результате проведенных исследований.
Система обеспечения качества предназначена для того, чтобы фармацевтическое предприятие могло гарантировать, что:
S разработка, испытания и изготовление лекарственных препаратов приведены с учетом требований GMP, GLP,GCP;
•J производство обеспечено утвержденными
технологическими регламентами и методиками, инструкциями, учитывающими правила GMP;
•J четко определена ответственность руководящего персонала за качество готового продукта, что должно быть установлено должностными инструкциями;
•J контроль качества исходного сырья, вспомогательных, упаковочных и маркировочных материалов проведены на стадиях их изготовления и/или поставки и перед применением в производстве;
•J проведена регистрация всех производимых контрольных испытаний сырья, вспомогательных упаковочных и маркировочных материалов, полуфабрикатов и готовых продуктов постадийного контроля процесса производства, калибровки приборов и валидация;
•J готовый продукт произведен в соответствии с утвержденными технологическими регламентами;
•J реализация готового продукта осуществлена только после получения соответствующего разрешения руководителя отдела контроля качества;
•J имеется документация, позволяющая контролировать условия хранения продукта, сроки годности у производителя, а также при транспортировке и реализации.
Система контроля качества, включающая объекты контроля, контрольные операции и их последовательность, техническое оснащение, методы, средства механизации, автоматизации и компьютеризации контрольных операций, являются неотъемлемой частью производственного процесса.
Выводы:
- Система Контроля Качества является одним из основных требовании GMP, поэтому ее разработка и внедрение - составляет основу работы Отдела Контроля Качества.
- создание Системы Контроля Качества - залог качества производимого лекарственного средства.
- Береговых В.В., Иващенко Н.В., Рудакова И.П., Пятигорская Н.В., Мешковкий А.П., Ляпунов Н.А. "Управление качеством в фармацевтической промышленности"// Под редакцией член- корр., проф. Береговых В.В., М.,2004 г. - 400 с.
- Туманов К.М. Формирование системы управления качеством на фармацевтическом предприятии на основе GMP.
- Нормирование фармацевтического производства. Обеспечение качества продукции. // Москва: "Ремедиум", 2001 г.
- СТ РК 1617-2006 Надлежащая производственная практика.