Нозокомиальные инфекции являются оДной из основных проблем современного зДравоохранения в силу своего повсеместного распространения. Обострение проблемы нозокомиальных инфекций обусловлено глобальным распространением антибиотикоустойчивости среДи микроорганизмов. Альтернативной стратегией борьбы с бактериальными инфекциями в условиях антибиотикорезистентности может стать применение литических бактериофагов.
Целью Данной статьи был обзор исслеДований, направленных на разработку и испытания фаговых препаратов, преДназначенных Для борьбы с оДним из основных возбуДителей нозокомиальных инфекций Pseudomonas aeruginosa (синегнойная палочка).
Синегнойная палочка - причина развития антибиотикоустойчивых нозокомиальных инфекций.
Бактерии рода Pseudomonas - большая гетерогенная группа микроорганизмов, способных приспосабливаться к различным физико-химическим условиям среды. В основе такого разнообразия лежит биохимическая способность усваивать в качестве основного источника углерода и азота разнообразные природные и синтетические соединения, включая большую группу токсичных веществ, таких как нафталин, толуол, фенол и т.д. Промежуточные соединения подобной деградации являются превосходными антибиотическими соединениями, дающими преимущество при освоении новых экотопов. Эти свойства данной группы микроорганизмов сочетают положительные и отрицательные стороныих практического применения в народном хозяйстве. С одной стороны, они широко применяются при борьбе с химическими загрязнениями, производстве микробных препаратов, нефтедобыче, а с другой являются бичом медицинских учреждений, которые используют большое разнообразие химических соединений. Бактерии рода Pseudomonas способны быстро расщеплять подобные соединения, что приводит к их активному росту и, как следствие, развитию нозокомиальных инфекций у пациентов с иммунодепрессивным состоянием [1,2].
Согласно текущему изданию Справочника Берджи по бактериологической систематике в роде идентифицированы 7 основных представителей, а именно в Pseudomonas aeruginosa, Pseudomonaschlororaphis, Pseudomonasfluorescens, Pseudomonaspertucinogena, Pseudomonasputida, Pseudomonasstutzeri и Pseudomonas syringae. Хорошо изученными видами являются: Pseudomonas syringae, один из фитопатогенов, поражающих различные виды растений, возбудитель инфекционных заболеваний насекомых - Pseudomonas entomophilia, является смертельным патогеном дляDrosophila melanogaster.Типовым представителем данного рода является Pseudomonas аeruginosa - оппортунистический патоген человека.
Pseudomonas aeruginosaпредставляет собой грамотрицательную и широко распространённуюв различных средах бактерию. Её можно обнаружить в воде и почве, онаявляется возбудителем инфекционных заболеваний животных и растений [3, 4]. Будучи условным патогеном человека, P. aeruginosaспособна вызвать широкий спектр опасных для жизни и здоровья острых и хронических инфекций, особенно у людей с нарушенной иммунной защитой, стать причиной развития внутрибольничных заболеваний среди госпитализированных пациентов и медицинского персонала. При этом борьбу с данным патогеном осложняет развитие у него устойчивости к широкому сектору антибиотических препаратов [5].
Данный возбудитель обладает эффективными механизмами адаптации к негативным воздействиям такими как «чувство кворума» (QS), подвижность, способность к образованию биопленок. Проводимые когортные исследования показали, что основной причиной развития нозокомиальных инфекций в европейских отделениях интенсивной терапии является синегнойная палочка, так же по последним оценкам в США ежегодно регистрируется до 51 тысячи случаев внутрибольничных инфекций, вызванных P. aeruginosa[6]. Согласно сообщению Международного комитета по контролю и надзору за нозокомиальными инфекциями, P. Aeruginosa и вызываемые ей инфекции стали одной из основных проблем мирового здравоохранения с 2016 года[7].
Резистентность P. aeruginosa ко многим противомикробным агентам, основана на взаимодействии нескольких основных механизмов. Один из главных - это низкая проницаемость наружных мембран по сравнению с другими грамотрицательными видами, что препятствует переносу многих антибиотиков внутрь клетки [8]. Помимо этого, P.aeruginosaобладает несколькими видами молекулярных насосов для выведения молекул, включаяMexAB-OprM [9], которыйпозволяет быстро исключить из метаболизмабактериальной клетки множество разнообразных соединений, в том числе некоторые антибиотики.
На генетическом уровне устойчивость к антибиотикам у P. aeruginosa определяется наличием генов b-лактамаз обладающих широким спектором изменчивости. Разнообразие данного гена, по данным Bush K. &Jacoby G.A., достигло 17 групп [10]. Подобная комбинация механизмов мутационного и приобретенного сопротивления приводит к резистентности почти ко всем противомикробным агентам. Сообщалось о штаммах, которые устойчивы практически ко всем классам обычно используемых антибиотиков, включая аминогликозиды, фторхинолоны, и в-лактамные антибиотики [11,12]. Особую озабоченность представляют штаммы генотипа А с локусом ST 235, широко распространенным на территории России, Венгрии, Сербии, Польше, Испании, Норвегии, Бразилии, Китае, Сингапуре, Нигерии и Казахстане [13].
На современном этапе развития науки, в направлении поиска и разработки новых химических антибактериальных препаратов, наблюдается снижение активности, при этом уже существующие антибиотики продолжают постепенно терять свою эффективность. Сохранение такой тенденции, в конечном итоге, приведёт к исчерпанию средств для борьбы с устойчивыми микроорганизмами [14].
На Генеральной Ассамблее ООН 21 сентября 2016 года при рассмотрении альтернативных стратегий профилактики и борьбы с бактериальными инфекциями было предложено пересмотреть отношение к практике фаговой терапии. Сторонники фаговой терапии указывают несколько основных преимуществ, которые бактериофаги имеют в отношении антибиотиков, таких как специфичность по отношению к хозяину, самоамплификация, деградация биопленки и низкая токсичность для людей [15, 16, 17, 18]. Поэтому использование литических бактериофагов для борьбы с инфекциями, вызванными антибиотикоустойчивыми штаммами P. aeruginosa является актуальным и естественным направлением развития современной фаготерапии.
Разнообразие бактериофагов, поражающих P. aeruginosa На сегодняшний день обнаружено, что 94,2% из 137 известных фагов, поражающих род Pseudomonas,принадлежат к отряду Caudovirales, который включает три семейства двухцепочечных ДНК (dsDNA) фагов, отличающихся характеристиками хвостового отростка фага: Podoviridae, с коротким и несокращающимся отростком; Myoviridae, с длинным и сокращающимся хвостом и Siphoviridae с длинным и несокращающимся хвостом [19 - 21]. До сих пор были выделены только 8 фагов Pseudomonas без хвостовых отростков: 2, принадлежащие к семейству Inoviridae (одноцепочечные ДНК [ssDNA] фаги) [22], 2, принадлежащие к семейству Leviviridae (ssRNA-фаги) [23], и 4, принадлежащих к семейству Cystoviridae (dsRNA-фаги) [24, 25].
Согласно собранным данным по всеми миру, 85% засеквенированных фагов Pseudomonas, принадлежащих к отряду Caudovirales, являются специфичными для вида P. aeruginosa и явное большинство (приблизительно 60%) из них представляют собой литические фаги, тогда как 21,8% являются умеренными, а 18,2% не классифицированы. Среди лизирующих фагов P. aeruginosa, 41% принадлежат к семейству Myoviridae, а 38% к семейству Podoviridae, а наименее представительная группа - сифовирусы(20%). Только 1% от количества литических фагов P. аeruginosa остаются неклассифицированными. Размеры геномов литических фагов P. aeruginosaразличных семейств довольно расходятся, так фаги семейства Myoviridae, обладают размером генома от 64,1 кб до 309,2 кб, тогда как геномы Podoviridae и Siphoviridaeфагов намного меньше и находятся в диапазоне от 41,6 до 74,9 кб и 34,5 до61,1 кб соответственно.
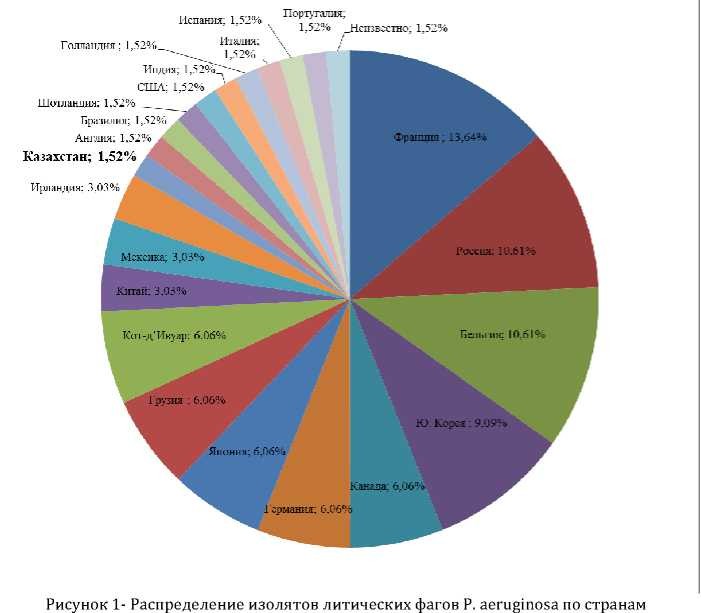
Литические фаги P. aeruginosaвыделяютсяиз различных источников по всему миру(рисунок 1),но наиболее вероятные места их обнаружения - это сточные воды, включая сточные воды больниц и места их очистки, откуда было выделено около 56% всех известных на сегодняшний день литических фагов P. aeruginosa[26].
Влияние бактериофагов на активность роста P. Aeruginosa invitro
В последние годы было проведено много исследований in vitro для оценки потенциала фагов против клинических изолятов P. aeruginosa, включая штаммы с множественной лекарственной устойчивостью (MDR), в планктонных культурах или в биопленках.
Ғис соавторами изучали влияние литических фагов на образование биопленок P.aeruginosa в катетерах, покрытых гидрогелем. Для этого они предварительно обрабатывали катетеры фагом M4 семейства Myoviridae в течение 2 часов до бактериальной инокуляции, через 24 часа после формирования биоплёнок, наблюдали уменьшение количества жизнеспособных клеток на 2,8 lg по сравнению с контролем (необработанными катетерами). Но в промежутке между 24 и 48 часами было зафиксировано возобновление роста биоплёнок. Изоляты биопленки, устойчивые к фагу, были извлечены из предварительно обработанных катетеров и, на основанииих профиля восприимчивости по отношению к другим фагам, был разработан коктейль из пяти бактериофагов. Предварительная обработка катетеров данной смесью фагов привелак сокращению количества жизнеспособных клеток в биоплёнкена 3 lg по сравнению с необработанными катетерами после 48 часов инкубации [27]. В результате проведённых Fu et al. исследований был получен достаточно эффективный фаговый препарат для борьбы с биоплёнками, формируемыми P. aeruginosa.
Наііс соавторами изучали влияние использования одного, двух или четырех фагов либо последовательно, либо одновременно против суспензионной культуры P. Aeruginosa PAO1. Было обнаружено, что полифаговый препарат более эффективен в снижении бактериальной плотности, а эффективность одновременного применения фагов равна или превосходит эффективность последовательного [28].
В других исследованиях, проводимых Piresetal. по контролю образования биопленок P. aeruginosaиспользовали фаг c широким диапазоном клеток - хозяев. И несмотря на то, что через 6 ч после обработки биопленки фагом происходило значительное сокращение количества жизнеспособных клеток, через 24 ч. наблюдали увеличение количестваклеток в биопленке, что указывало на возникновение фагоустойчивых фенотипов [29].
Таким образом, вышеприведенные исследования, а также другие многочисленные исследования доказывают, что комбинация двух или более фагов с различным диапазоном хозяев в одной суспензии - фаговом коктейле - болееэффективна, чем использование только одного фага [30 - 32].
Также был изучен альтернативный подход контроля роста P. aeruginosa - сочетание фагов с другими противомикробными препаратами. Torres-Barcelo etal. проводили исследования, при котором использовали комбинацию Podoviridaephage LUZ7 и стрептомицина против P. Aeruginosa PAO1. В экспоненциальную фазу роста культуры P. Aeruginosa добавляли либо каждый препарат по отдельности, либо в комбинации, после чего отслеживали препарата по отдельности[33].
плотность популяции бактерий в течение 70 часов. Комбинированный препарат показал положительный синергизм, в результате чего плотность бактерий была ниже, чем наблюдалась после добавления каждого в сочетании с гентамицина (цефалоспорина), субингибирующими (аминогликозида), ципрофлоксацина Knezevitt соавторами также изучали эффективность антимикробных препаратов, состоящих из специфичных к P. aeruginosa фагов, принадлежащих к семействам Podoviridae и Siphoviridae концентрациями цефтриаксона (хинолона) и полимиксина B ( полипептид). Эффективность комбинированных препаратов определялась методом кривой критического времени (time-killcurve), и только комбинация цефтриаксона с одним из фагов, используемых в исследовании, выявила синергический эффект [34]. В другой работе сообщалось обиспользовании смеси, состоящей из литических РНК-фагов в сочетании с хлором против биопленок P. aeruginosa, в ходе чего была выявлена повышенная эффективность данной смеси в снижении образования биопленки или ее уничтожение по сравнению с результатами использования каждого компонента смеси отдельно[35].
Обзора приведённых выше исследований показывает, что в экспериментах invitro бактериофаги и созданные на их основе препараты способны значительно снижать или даже полностью уничтожать устойчивые штаммы P. aeruginosa, что создаёт большие перспективы для использования фаговой терапии против антибиотикоустойчивых инфекций, вызываемых данным возбудителем.
Клинические испытания бактериофагов P. Aeruginosa на моделях животных.
Эффективность и безопасность фаговой терапии были проанализированы в экспериментах in vivo с использованием животных. Большая часть клинических испытаний препаратов на основе фагов P. аeruginosa, о которых сообщалось в последнее десятилетие, были проведены на моделях мышей и показали чрезвычайно обнадеживающие результаты.
KenFukudaс соавторами изучали терапевтический эффект фага KPP12 (семейства Myoviridae), выделенного из реки Кочи, Япония, на 8-ми недельных мышах. На роговицах левого глаза у восьминедельных мышей линии C57BL/6 под визуализацией стереоскопического микроскопа, стерильной иглой проводились три 1 мм царапины. После чегона поверхность роговицы наносили 5 мл суспензии, содержащей 5*106 клеток P. Aeruginosa штаммРА33. Через 30 минут после заражения поверхность роговицы обрабатывали 5 мл жидкости содержащей 5*108 бляшкообразующих единиц (БОЕ)фага. Глаза мышейобследовали через 1, 3 и 5 дней после инфицирования для определения степени тяжести заболевания. В результате исследования было показано, что у мышей, которым однократно обрабатывали глаза каплями, содержащими бактериофаг KPP12, в первый день после заражения имелись незначительные повреждения роговицы, которые постепенно исчезли на 5 день наблюдений. Инфицированные контрольные мыши, глаза которых не подвергались обработка бактериофагом, имели обширные повреждения роговицы и её полную непрозрачность через 5 дней после заражения P. aeruginosa[36].
Alemayehu с соавторами изучали способность фагов фMR299-2 (семейства Podoviridae) ифNH-4(семейства Myoviridae), выделенных из сточных вод на очистных сооружениях, лизировать псевдомонады в легких у 8недельных самок мышей линии BALB. Для этого мышей инфицировали бактериями P.aeruginosa, трансформированными плазмидой p16Slux (маркированные генами люциферазы) для облегченного наблюдения за распространением клеток Pseudomonas по тканям легких в режиме реального времени. Через 2 часа после заражения в лёгких инфицированных мышей было зафиксировано достаточное наличие бактерий P. aeruginosa, затем экспериментальной группе мышей через дыхательные пути распыляли суспензию исследуемых бактериофагов. Через 6 часов наблюдений в лёгких контрольной группы мышей, которая не подвергалась обработке бактериофагами, фиксировали увеличение P. aeruginosa в 3 раза, в то время как в лёгких мышей обработанных бактериофагами наблюдали снижение количества псевдоманад на величину от 3 до 4 логарифмических единиц по сравнению с исходным количеством бактерий. [37].
Morell соавторами оценивали лечение легочной инфекции у мышей при использовании бактериофага P3_CHA (Myoviridae), выделенного из сточных вод. Легочную инфекцию у экспериментальных животных вызывали летальной дозой (3*106 колониеобразующих единиц (КОЕ)) мукоидного штаммаР. aeruginosa с множественной лекарственной устойчивостью. Данный штамм был выделенн у пациента с кистозным фиброзом. Бактерии и бактериофаги мышамвводили интраназально. В течении всего срока наблюдения фиксировали гибель животных, анализировали бронхоальвеолярную жидкость, проводили количественную оценку бактерий, бактериофагов, противовоспалительных и цитотоксических маркеров, а также анализ гистологии и иммуногистохимии. В результате проведённых исследований было показано, что одной дозы бактериофага в размере 3*108 БОЕ, введенной через 2 часа после заражения, достаточно для выживания95%инфицированных животным.
Четырехдневное профилактическое лечение той же дозой бактериофага приводило к выживанию 100% инфицированных мышей [38].
Olszata соавторами оценивали антибактериальную активность бактериофагов, выделенных из сточных вод с полей орошения расположенных во Вроцлаве, Польша. Предварительно были отобраны штаммы бактериофагов, обладающие максимальной литической активностью - PA5oct и KT28. Электронно-микроскопический анализ данных штаммов позволили их отнести к семейству Myoviridae отряда Caudovirales согласно основным морфологическим признакам.
Для изучения возможных вариации чувствительности к фагу были выбраны шесть изолятов P. aeruginosa: PAO1 в качестве эталонного штамма, non-CF0038, клинический штамм, выделенный из зараженной раны; CF217 (уникальный кластер, раннее инфекционное заболевание); CF708 (кластер 1, поздняя инфекция), CF532 не мукоидный изолят и CF832 мукоидный изолят от пациента с кистозным фиброзом.
Анализ антибактериальной активности фагов PA5oct и KT28 проводили in vivo на модели личинок G. mellonella. Личинки предварительно подвергались 7-дневной акклиматизации. Определения степени патогенности штаммов P. aeruginosa проводили путём введения личинкам 10 мкл разбавленной бактериальной суспензии, серийно разведённой до 10-8 КОЕ. Как бактерии, так и бактериофаги личинкам вводили инъекционно в вентральную часть последней пары псевдоподий. После инъекции личинки инкубировали 72 ч при 37° С. Степень заражения фиксировали по проценту выживаемости и макроскопическому виду личинок через 8, 24, 48, 72 и 96 ч после инъекции.
Для оценки антибактериальной активности исследуемых фагов, личинкам вводили 10 мкл бактериальной суспензии и через 1 ч, 10 мкл фаголизата при титровании которого, множественность инфекции (МИ) равна 100. Каждый эксперимент проводили в течение 72 ч при 37°С, результаты фиксировали на 8, 24, 48 и 72 ч. Результаты выражали через процент выживаемости.
В результате определения степени патогенности было показано, что изоляты P. aeruginosa PAO1, non-CF0038 и CF217 были смертельными в дозе 10 КОЕ, при введениикоторой, после 1 дня наблюдений отмечали более 90% гибели личинок. Для остальных штаммов летальная доза была установлена в 105 КОЕ.
По результатам исследований антибактериальной активности фагов было установлено что, бактериофаг KT28 был наиболее эффективным, по сравнению с фагом PA5oct в отношении не фиброзно-кистозных штаммов P. aeruginosa (PAO1, non-CF0038), процент выживаемости личинок составил около 20% даже через 2 дня после применения смертельной дозы P. aeruginosa. Кроме того, препарат KT28 был более эффективен против изолята P. aeruginosa CF708 в сравнении с фаговым препаратом PA5oct. Применение фаговых препаратов KT28 или PA5oct по отдельности для лечения инфекции фагоустойчивого штамма CF217 не было эффективным, тогда как смесь обоих лизатов фагов увеличивало коэффициент выживания личинок G. mellonellagо 30 и 20% на 24 и 48 ч соответственно [39].
Бактериофаговая терапия P. aeruginosa может с успехом использоваться в сельском хозяйстве и ветеринарии. Так KhairnarKet.alпоказали влияние бактериофаговой терапии на инфекцию Р. aeruginosaс множественной лекарственной устойчивостью у пресноводного сома C. Gariepinus, который является важной промысловой рыбой[40 - 42].
Исследуемые бактериофаги были выделены из сточных вод Индии, на основании электронно-микроскопического анализаи данных секвенирования фаги были отнесены к семейству Podoviridae.B эксперименте, фаговую суспензию в концентрации 1010 БОЕ / мл наносили ватным тампоном на места инфекционного поражения кожи рыб. Терапевтический эффект от применения фагового препарата проявился через 8-10 дней, в результате которого было установлено уменьшение диаметра кожных пораженийв 7 раз по сравнению с кожными поражениями необработанной фаговым препаратом рыбы [40].
Hawkins соавторами проводили оценку терапевтической активности6 штаммов бактериофагов при лечении хронического отита собак, вызванного Р. aeruginosa. Собакам с хроническим отитом во внешний слуховой канал вводили 105 БОЕ каждого из 6 исследуемых штаммов бактериофага, активных против Р. aeruginosa. Во время введения бактериофага и через 48 ч после введения была измерена внутрення температура каждой собаки и подсчитано среднее количество фагов и клеток бактерий. Через 48 ч после лечения, клинический балл и количество клеток бактерийР. aeruginosa из ушей значительно уменьшились: среднее снижение балла на 30,1%, уменьшение среднего количества клеток Р. aeruginosa на 67%,количество бактериофагов увеличилось по сравненью с вводимой дозой в среднем в 99,1 раза. Во время эксперимента не было обнаружено воспаления, вызванного лечением или других побочных эффектов. Это первый отчет о ветеринарном клиническом исследовании бактериофагового терапииданной инфекции. Результаты показывают, что введение смеси бактериофагов приводит к лизису Р. aeruginosa в ухе без явной токсичности [43].
Козлова Ю.Н. и др. изучали возможность применения специфического фага ph 57, выделен из экскрементов животных вивария, для лечения у крыс экспериментальной пневмонии, вызванной синегнойной палочкой.Животным вводили суспензиюР. aeruginosaобъёмом 500 мкл с титром 109 КОЕ/мл и подвергали воздействию низких температур. Через сутки после заражения крысам перорально вводили 500 мкл бактериофага ph 57 с титром 8*107 БОЕ/мл, на третьи сутки производили повторное введение бактериофага в той же дозе. В результате эксперимента было показано, что в течении 8 дней наблюдения ни одно животное получавшее бактериофаг не погибло. Гиподинамия и внешние признаки дыхательной недостаточности исчезли к 4-м суткам наблюдения. Из образцов тканей органов крыс методом отпечатков на среду РПА не было высеяно инфекционного штамма. В контрольной группе животных, которым не вводили бактериофаг отмечали наличие гиподинамии, затруднения дыхание с влажными хрипами. Из печени и легких животных этой группы методом отпечатков был произведен посев на питательную среду РПА с последующей фиксацией сплошного роста инфекционного штамма Р. aeruginosa. [44]. Обзор выше приведённых исследований показал, что фаговая терапия значительно способствовала контролю, и профилактики инфекций Р. aeruginosa in vivo. Клинические испытания на моделях различных животных подтверждают терапевтическую эффективность антибактериальных фаговых препаратов, а такжеполное отсутствие у них токсичности. Поэтому использование бактериофагов в клинической практике для профилактики и лечения инфекций, вызванных Р. aeruginosa является весьма перспективным.
Клинические испытания бактериофагов P. aeruginosa на людях.
Впервые бактериофаги в терапевтических целях применили в Париже в 1919 году, когда Д'Эрелльвводил перорально препарат фага для лечения бактериальной дизентерии [45]. Пациенты, получавшие однократную дозу фагосодержащего препарата начали восстанавливаться в течение 24 часов после начала лечения [46]. В совместной работе д'Эрелля и Ашишова, опубликованной в 1931 году, описывается способ лечения холеры у людей путём внутривенного ведения бактериофага. Так же при участии д'Эрелля доктор Давиуд во Франции смог вылечить «безнадежный» случай стафилококковой бактериемии, вводя пациенту смесь фага с физиологическим раствором в объёме 500 мл в течении одного часа [47, 48]. В 1921 году Bruynoghe и Maisin была опубликована работа в которой сообщалось, о применении фагов для лечения кожных заболеваний, вызванных стафилококками (фурункулы и карбункулы) у 6пациентов. Через 48 часов после фаготерапии у больных фиксировали снижение болевых ощущений, отёка и температуры [49].
В первой половине ХХ века фаготерапия представляла собой перспективное направление,по которому проводилось много исследований, показывающих эффективность использования бактериофагов в терапевтических целях [50, 51]. Но после открытия антибиотиков Флемингом и началом применения их в клинической практике массовый интерес к бактериофагам как к терапевтическим препаратам снизился. Вновь интерес к бактериофагам, как к средствам борьбы с бактериальными инфекциями приобрёл всеобщий характер в XXI веке, после развития и распространения антибиотикоустойчивости у бактерий.
В 2009 году Wright с соавторами опубликовали работу о клинических испытаниях фагового препарата (Biophage-PA) против инфекций Р. aeruginosa. По данным авторов, 12 пациентов с хроническим отитом, вызванным антибиотикорезистентным Р. aeruginosa, получали однократную дозу данного препарата.После 7, 21 и 42 дней лечения были зарегистрированы значительные клинические улучшения по сравнению с 12 пациентами, получавшими плацебо. Кроме того, при применении фагового препарата у пациентов не наблюдали проявления каких-либо местных или системных побочных эффектов и токсичности, что подчеркивает безопасность фаговой терапии [52].
Sivera Marza с соавторами сообщили об успешном использовании фага при его местном применении для лечения ожоговых ран пациента, инфицированных Р. aeruginosa. Для терапии применяли очищенный фаговый препарат, адсорбированный на фильтровальных бумажных дисках, которые помещались на ожоговые, инфицированные участки кожи пациента. Через 3 дня после лечения инфекционный штамм не высеивался на питательную среду [53].
Merabishvili с соавторами описали мелкомасштабное производство фагового коктейля (BFC-1) с контролируемым качеством для использования в клинической практике человека. Коктейль был разработан для лечения инфекций Р. aeruginosa и St. aureus при ожоговых ранах.Авторами были оценены параметры контроля качества фагового коктейля, такие как стабильность, пирогенность, стерильность ицитотоксичность [54].Фаговый коктейль BFC-1 местно применяли на ожоговых ранах девяти пациентов, инфицированных мультирезистентными P. aeruginosa и/или S. aureus. Хотя это исследование не дало результатов относительно терапевтической эффективности фагового коктейля, проявление неблагоприятных эффектов или клинических аномалий при его применении не наблюдалось [55].
Обзор вышеприведённых материалов показал отсутствие каких-либо побочных или токсичных эффектов как об результативности применения при лечении бактериальных aeruginosa. Всё это позволяет бактериальными актуальность исследований местного, так и системного характера после испытаний фаговых препаратов на людях. Так же данные исследования свидетельствуют бактериофагов инфекций,вызванных P. aeruginosa. Всё сделать выводы, что фаготерапия является эффективным и безопасным методом борьбы с инфекциями и имеет высокую перспективность для дальнейших внедрения в клиническую практику.
СПИСОК ЛИТЕРАТУРЫ
- Moradali M.F., Ghods S., Rehm H.A. Pseudomonas aeruginosa Lifestyle: A Paradigm for Adaptation, Survival, and Persistence // Front Cell Infect Microbiol. - 2017. - Vol. 7. - doi: 10.3389/fcimb.2017.00039
- Lam J.S., Taylor V.L., Islam S.T., Hao Y., Kocrncova D. Genetic and Functional Diversity of Pseudomonas aeruginosa Lipopolysaccharide // Front Microbiol. - 2011. - Vol. 2. - doi: 10.3389/fmicb.2011.00118
- Pereira S.G., Rosa A.C., Ferreira A.S. et al. Virulence factors and infection ability of Pseudomonasaeruginosa isolates from a hydropathic facility and respiratoryinfections // J. Appl.Microbiol. - 2014. - Vol.116. - P. 1359-1368.
- Wagner V.E., Filiatrault M.J., Picardo K.F., Iglewski B.H.Pseudomonas aeruginosa virulence and pathogenesis issues // Pseudomonas genomics and molecular biology. - Norfolk, United Kingdom:Caister AcademicPress, 2008. - P. 129-158.
- Athanasiou C.I., Kopsini A. A systematic review on the use of time series data in the study of antimicrobial consumption and Pseudomonas aeruginosa resistance // J. Glob. Antimicrob. Resist. - 2018. - №2. - Р. 88-97.
- Lambert M.L., Suetens C., Savey A. et al. Clinical outcomes of health-care-associated infections and antimicrobial resistance in patients admitted to European intensive-care units: a cohort study // Lancet Infect. Dis. - 2011. - Vol. 11. - P. 30-38.
- Rosenthal V.D., Al-Abdely H.M., El-Kholy A.A. et al. International nosocomial infection control consortium report, data summary of 50 countries for 2010-2015: device-associated module // Am. J. Infect. Control. - 2016. - Vol. 44. - P. 1495-1504.
- Breidenstein E.B., Fuente-Nunez C, Hancock R.E. Pseudomonas aeruginosa: all roads lead to resistance // Trends Microbiol. - 2011. - Vol. 19. - P. 419-426.
- Li X., Nikaido H., Poole K. Role of mexA-mexB-oprM in antibiotic efflux in Pseudomonas aeruginosa //Antimicrob. Agents Chemother. - 1995. - Vol. 39. - P. 1948- 1953.
- Bush K., Jacoby G.A. Updated functional classification of-beta-lactamases //Antimicrob. Agents Chemother. - 2010. - Vol. 54, №3. - P. 969-762.
- Hancock R.E.W., SpeertD.P. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and impact on treatment // Drug Resist. Update. -2000. - Vol. 3. - P. 247-255.
- Poole K. Pseudomonas aeruginosa: resistance to the max // Front. Microbiol. -2011. - Vol. 2. -Р. 25-34.
- ВоронинаО.Л., КундаМ.С., АветисянЛ.Р., ЧернухаМ.Ю., ГабриэлянН.И., ШагинянИ.А., ЛунинВ.Г. Особенностиштаммов Pseudomonas aeruginosa, вызывающихгоспитальныеинфекцииупациентовхирургическихотделенийФНЦТИОим. В.И. Шумакова // Клин микробиол.антимикроб.химиотер. - 2012. - Том 14, № 2. - С. 88-99.
- Асланов Б.И. Эпидемиологическая оценка бактериофагов как факторов эволюции госпитальных штаммов и средств борьбы с внутрибольничными инфекциями: автореф. дис. ... д-р. мед. наук - СПб, 2016. - 44 с.
- Bourdin G., Navarro A., Sarker S.A. at al. Coverage ofdiarrhoea-associated Escherichia coli isolates from different origins with two types of phage cocktails //Microb.Biotechnol. -2014. - Vol.7. - P. 165-176.
- Donlan R.M. Preventing biofilms of clinically relevant organisms using bacteriophage //Trends Microbiol. -2009. - Vol.17. - P. 66-72.
- Lin D.M., Koskella B., Lin H.C. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance // W. J. of Gastro. Pharma. and Thera. - 2017. - Vol. 8, №3. - P. 162-173.
- Scarascia G., Yap S.A., Kaksonen A.H., Hong P.Y. Bacteriophage Infectivity Against Pseudomonas aeruginosa in Saline Conditions // Front.Microbiol. - 2018. - Vol. 9. - Р. 146-152.
- Ceyssens P.J., Lavigne R.Bacteriophages of Pseudomonas // Future Microbiol. -2010. - Vol. 5. - P 1041-1055.
- Azeredo J., Sillankorva S., Pires D.P. Pseudomonas bacteriophage isolation and production. Pseudomonas methods and protocols. -NY: Humana Press, 2014. - P. 23-32.
- Ackermann H.W. Phage classification and characterization // Methods Mol. Biol. -2009. - Vol. 501. - P. 127-140.
- Holland S.J., Sanz C., Perham R.N.Identification and specificity of pilus adsorption proteins of filamentous bacteriophages infecting Pseudomonasaeruginosa // Virology. -2006. - Vol. 345. - P. 540-548.
- Ruokoranta T.M., Grahn A.M., Ravantti J.J.at al.Complete genome sequence of the broad host range single-strandedRNA phage PRR1 places it in the Levivirus genus with characteristicsshared with alloleviviruses // J.Virol. -2006. - Vol. 80. - P. 9326-9330.
- Hoogstraten D., Qiao X., Sun Y.at al.Characterization of phi8, a bacteriophage containing three doublestranded RNA genomic segments and distantly related to Phi6 // Virology. -2000. - Vol. 272. - P. 218-224.
- Gottlieb P., Wei H., Potgieter C., Toporovsky I. Characterization of phi 12, a bacteriophage related to phi 6: nucleotide sequence of the small and middle double-stranded RNA // Virology. -2002. - Vol. 293. - P. 118-124.
- PiresD.P., Vilas B.D., SillankorvaS., AzeredoJ. Phage Therapy: a Step Forward in the Treatment of Pseudomonas aeruginosa Infections // Journal of Virology - 2015. - Vol.89, №15. - P. 7449-7456.
- Fu W., Forster T., Mayer O. at al. Bacteriophage cocktail for the prevention of biofilm formation by Pseudomonasaeruginosa on catheters in an in vitro model system // Antimicrob. Agents Chemother. -2010. - Vol. 54. - P. 397-404.
- Hall A.R., De Vos D., Friman V.P. at al. Effects of sequential and simultaneous applications of bacteriophagesonpopulations of Pseudomonas aeruginosa in vitro and in wax moth larvae // Appl. Environ.Microbiol. - 2012. - Vol. 78. - P. 5646-5652.
- Pires D., Sillankorva S., Faustino A., Azeredo J. Use of newly isolated phages for control of Pseudomonas aeruginosa PAO1 and ATCC 10145 biofilms // Res Microbiol. -2011. - Vol. 162. - P. 798-806.
- Gu J., Liu X., Li Y. at al.A method for generation phage cocktail with greattherapeutic potential // PLoS One. -2012. - Vol. 7, №3. - Р. 1219.
- Chan B.K., Abedon S.T., Loc-Carrillo C. Phage cocktails and thefuture of phage therapy // Future.Microbiol. -2013. - Vol. 8. - P. 769-783.
- Jaiswal A., Koley H., Ghosh A. at al. Efficacy of cocktailphage therapy in treating Vibrio choleraeinfection in rabbit model // MicrobesInfect. - 2013. - Vol. 15. - P. 152-156.
- Torres-Barcelo C., Arias-Sanchez F.I., Vasse M. at al. A window of opportunity to control the bacterial pathogen Pseudomonas aeruginosa combining antibiotics and phages // PLoS One. -2014. - Vol. 9. - Р. 239-246.
- Knezevic P., Curcin S., Aleksic V. at al.Phageantibiotic synergism: a possible approach to combatting Pseudomonasaeruginosa // Res.Microbiol. - 2013. - Vol. 164. - P. 55-60.
- Zhang Y., Hu Z. Combined treatment of Pseudomonas aeruginosa biofilms with bacteriophages and chlorine // Biotechnol.Bioeng. -2013. Vol. 110. - P. 286-295.
- Fukuda K., Ishida W., Uchiyama J. at al. Pseudomonasaeruginosa keratitis in mice: effects of topical bacteriophage KPP12 administration // PLoS One. -2012. - Vol. 7. - Р. 52-63.
- Alemayehu D., Casey P.G., McAuliffe O. at al. Bacteriophages _MR299-2 and_NH-4 can eliminate Pseudomonas aeruginosa in the murine lung and oncystic fibrosis lung airway cells // MBio. -2012. - Vol. 3. - Р. 212-219.
- Morello E., Saussereau E., Maura D. at al. Pulmonary bacteriophage therapy on Pseudomonas aeruginosa cysticfibrosis strains: first steps towards treatment and prevention // PLoS One. -2011. - Vol. 6. - Р. 26-38.
- OlszakT. et al. In vitro and in vivo antibacterial activity of environmental bacteriophages against Pseudomonas aeruginosa strains from cystic fibrosis patients // Appl.Microbiol.Biotechnol. - 2015. - Vol. 99. - P. 6021-6033.
- Khairnar K., Raut M.P., Chandekar R.H. at al. Novel bacteriophage therapy for controlling metallo-beta-lactamase producing Pseudomonas aeruginosa infection in catfish // BMC Vet. Res. -2013. - Vol. 9. - Р. 66-75.
- Sanmukh S.G., Meshram D.B., Paunikar W.N., Swaminathan S. Interaction offishes with pathogenic bacteria and application of phages for their control-a review // Rev fish Biol. Fisheries. - 2012. - Vol. 22. - P. 567-574.
- Osman A.G.M., McKkawy I.A., Verreth J.J., Kirschbaum F. Effects of lead nitrate on the activity of metabolic enzymes during early developmental stages of the African catfish, Clariasgariepinus (Burchell, 1822) // Fish Physiol.Biochem. - 2007. - Vol. 33. - P. 11-23.
- Hawkins C., Harper D., Burch D., Anggard E, Soothill J. Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial // Vet.Microbiol.- 2010. - Vol. 146. - P. 309-313.
- Козлова Ю.Н., Репин В.Е., МайбородинИ.В. «Специфический бактериофаг для лечения хирургической инфекции, вызванной Pseudomonas Aeruginosa, в эксперименте» // Вест. Экспери. и клин. хирургии. - 2013. - ТомѴІ, №4. - С. 425-431.
- Sulakvelidze A., Kutter E. Bacteriophage therapy in humans // In Kutter E, Sulakvelidze A (ed), Bacteriophages: Biology and Applications. Boca Raton, FL: CRC Press LLC, 2004. - P. 381-436.
- Sulakvelidze A., Alavidze Z., Morris J.G. Bacteriophage therapy //Antimicrob. Agents Chemother. -2001. - Vol. 45. - P. 649-659.
- d'Herelle F. An Address on bacteriophagy and recovery from infectious diseases // Can Med Assoc J. - 1931. - Vol. 24. - P. 619-628.
- d'Herelle F. Bacteriophage as a treatment in acute medical and surgical infections // Bull N Y Acad Med. - 1931. - Vol. 7. - P. 329-348.
- Bruynoghe R, Maisin J. Essais de therapeutique au moyen du bacteriophage du Staphylocoque // Compt Rend Soc Biol. - 1921. - Vol. 85. P. 1120-1121.
- Rice TB. Use of bacteriophage filtrates in treatment of suppurative conditions: report of 300 cases // Am. J. Med. Sci.- 1930. - Vol. 179. - P. 345-360.
- Schless R.A. Staphylococcus aureus meningitis: treatment with specific bacteriophage // Am. J. Dis. Child. -1932. - Vol. 44. - P. 813-822.
- Wright A., Hawkins C.H., Anggard E.E., Harper D.R. A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy // Clin.Otolaryngol. -2009. - Vol. 34. - P. 349-357.
- SiveraMarza J.A., Soothill J.S., Boydell P., Collyns T.A. Multiplication of therapeutically administered bacteriophages in Pseudomonasaeruginosa infected patients // Burns. -2006. - Vol. 32. - P. 644-646.
- Merabishvili M., Pirnay J.P., Verbeken G. at al. Quality-controlled small-scaleproduction of a well-defined bacteriophage cocktail for use in humanclinical trials // PLoS One. -2009. - Vol. 4. - Р. 36-42.
- Rose T., Verbeken G., Vos D.D. at al.Experimental phage therapy ofburn wound infection: difficult first steps // Int. J. Burns Trauma. - 2014. - Vol. 4. - P. 66-73.