Субтотальная пластика пищевода тонкой кишкой является перспективным направлением восстановительной хирургии пищевода. Работы выдающихся хирургов: П.А. Герцена, А.Г. Савиных, С.С. Юдина, А.А. Русанова, П.И. Андросова, В.И. Казанского, Б. В. Петровский, В.И. Филина, М.И. Давыдова, А.Ф. Черноусова, А.И. Пирогова, А.С. Мамонтова, В.И.Столярова, Б.И. Мирошникова и многих других исследователей позволили расширить показания к операциям и значительно повысить эффективность эзофагопластики при хирургическом лечении больных по поводу рака и других забодеваний пищевода. Данная операция имеет ряд преимуществ: Во-первых, при выборе материала для замещения пищевода многие авторы изначально отдавали предпочтение тонкой кишке, т. к. по своим пластическим качествам и соответственно тканям пищевода она во многом превосходит не только толстую кишку, но и желудок. Во-вторых, этот метод является наименее травматичным и наиболее физиологичным из всех существующих способов, т. к. сегментарная тонкокишечная вставка в дефект пищевода позволяет максимально сохранить его анатомичность и систему антирефлюксных жомов. Кроме того, даже в условиях повторной реконструктивной операции и жесткого дефицита пластического материала практически всегда можно резецировать сегмент тонкой кишки без существенного ущерба для функции пищеварения. К основным достоинствам тонкокишечной эзофагопластики относятся: относительно малая травматичность операции, близость диаметров пищевода и тонкой кишки, хорошие функциональные качества трансплантата благодаря сохранению его перистальтической активности, возможность повторной реконструкции после неудавшейся или незавершенной эзофагоеюнопластики (Юдин С.С., 1954; Русанов А.А., 1974; Масюкова Е.М., Тун В.Г., 1985; Астрожников Ю.В. и соавт., 1986; Белоусов Е.В. и соавт., 1991; Столяров В.И. и соавт., 1996; Хитреев В.Е., 2003; Higashino M. et al., 1991, Hirabayashi S. et al., 1993; Stein H.L., 2001; Stier A. et al., 2003, и др.). Необходимость решения этих проблем на пути к более широкому и успешному внедрению метода пластики пищевода свободным сегментом тонкой кишки и определяет актуальность представленной работы.
Актуальность проблемы. Субтотальная эзофагопластика тонкой кишкой на сосудистой ножке сейчас применяется в исключительных случаях, в основном из-за общепризнанных неблагоприятных особенностей её ангиоархитектоники, особенности которой, не позволяют обеспечить гарантированное кровоснабжение трансплантата на всём его протяжении. Помимо этого, хирурги часто имеют дело с проблемой несоответствия длины кишки длине брыжейки и её сосудов, которые значительно меньше. Выраженная извилистость петель тонкой кишки приводит к перегибу или провисанию трансплантата, что в последующем отрицательно сказывается на моторно-эвакуаторной функции искусственного пищевода (Шалимов А.А., Саенко В.Ф., 1987; Бакиров А.А., 2001).
Перспективным направлением восстановительной хирургии пищевода, особенно в условиях повторной реконструктивной операции, можно было бы считать метод пластики пищевода свободным сегментом тонкой кишки на микрососудистых анастомозах. Этому способствуют две причины. Во-первых, при выборе материала для реконструктивных операций на пищеводе многие авторы изначально отдавали предпочтение тонкой кишке, т.к. по своим пластическим качествам она превосходит не только толстую кишку, но и желудок; по целому ряду причин: а) является готовой физиологичной трубкой с диаметром, соответствующим пищеводу; б) отсутствует продольный ряд швов, который неизбежен на желудочном трансплантате; в) ткани тонкой кишки в наибольшей степени подобны тканям пищевода; г) стенка тонкой кишки гораздо тоньше и эластичнее желудочной; д) содержимое тонкой кишки обладает менее выраженным септическим эффектом по сравнению с толстой кишкой; е) практически нет недостатка в донорской ткани. Во-вторых метод пластики пищевода свободным сегментом тонкой кишки обладает неоспоримыми достоинствами: 1) операция наименее травматична изо всех существующих на сегодняшний день способов, т.к. выкраивание до 50 см тонкого кишечника с последующим наложением анастомоза «конец в конец» никак не сказывается на функции пищеварения; 2) сегментарная тонкокишечная вставка в пищевод позволяет максимально сохранить его анатомичность и систему антирефлюкс-ных жомов; 3) имеется возможность выполнения операции в один этап; 4) метод позволяет соблюдать общепринятые принципы онкологических операций; 5) операция обеспечивает не только хороший функциональный результат, но и удовлетворяет требования эстетики даже при подкожном проведении трансплантата.
Необходимость решения проблем на пути к более широкому и успешному внедрению метода пластики пищевода свободным сегментом тонкой кишки и определяет актуальность представленной работы.
Целью исследования — является метод пластики пищевода свободным реваскуляризируемым сегментом тонкой кишки, который сохраняет свое практическое значение в ряду современных методов реконструктивных операций на пищеводе за счет уникальной возможности применения его в условиях жесткого дефицита пластического материала.
Субтотальная пластика пищевода тонкой кишкой.
Показания: все доброкачественные (не поддающиеся лечению блокированием) и злокачественные стриктуры пищевода (если для его шунтирования или замещения нельзя использовать толстую кишку или желудок).
Противопоказания: состояние после резекции кишки, резекции желудка по Бильрот-П, особенно на длинной петле с брауновским соустьем, когда тонкую кишку для формирования трансплантата использовать невозможно.
Специальная подготовка: антибактериальная профилактика по описанной выше схеме. Специальный инструментарий: ложки (копья) С.С.Юдина.
Позиция больного: на спине с валиком под поясницей. Анестезия: эндотрахеальный наркоз.
Доступ: широкая верхняя срединная лапаротомия с обходом пупка слева
Основные этапы и техника операции.
Если у больного имеется гастростома, трубку удаляют, свищ закрывают плотно свернутым марлевым тампоном. После лапаротомии и рассечения спаек выводят в рану поперечную ободочную кишку. Ее растягивают и запрокидывают вверх, обнажая нижнюю поверхность брыжейки. Выводят в рану начальный отдел тощей кишки и натягивают ее книзу. После этого хорошо визуализируется трейтцева связка. Здесь рассекают сращения тощей кишки с брыжейкой поперечной ободочной кишки, освобождают начальный отдел тощей кишки до ее забрюшинной части. Впереди от тощей кишки и справа от трейтцевой связки находят верхние брыжеечные сосуды, после этого поперечную ободочную кишку погружают в брюшную полость. Осматривают тощую кишку и ее сосуды в проходящем свете; перебирая петлю за петлей, выявляют анастомозы между радиальными сосудами и вторичными аркадами. С.С.Юдин не рекомендовал использовать для формирования тощекишечного трансплантата 1-й радиальный сосуд, так как, по его данным, он весьма короток и сразу делится на мелкие ветки в виде «кисточки», которая препятствует распрямлению конца будущего трансплантата. Однако, по данным А.А.Русанова (1974), между 1-м и 2-м еюнальными сосудами в 90 % случаев имеется достаточно мощный анастомоз. Если же он отсутствует, тогда действительно необходимо начинать мобилизацию со 2-го еюнального (радиального) сосуда.
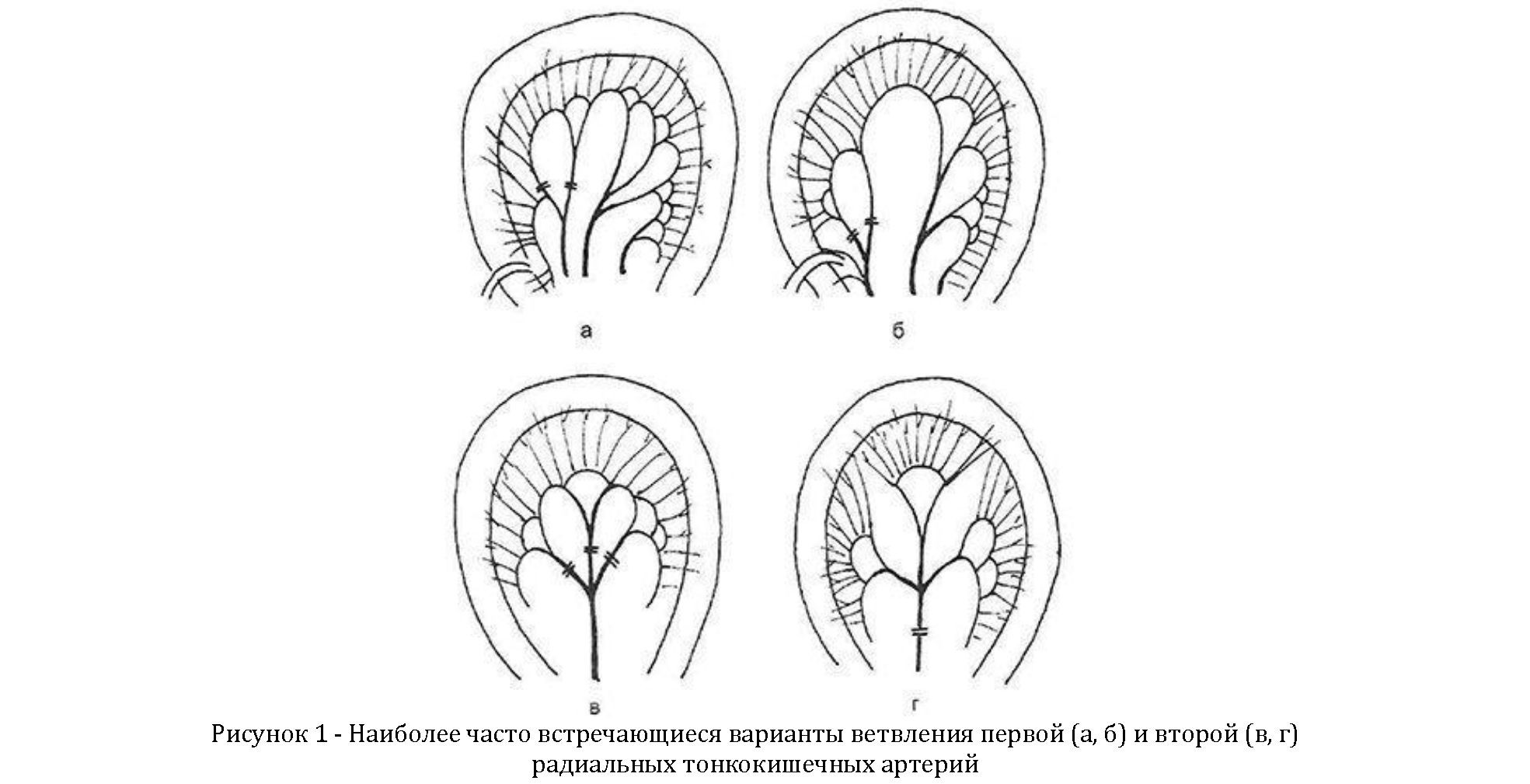
Таким образом, на начальном этапе необходима ревизия сосудистой сети брыжейки: а) анастомозов между аркадами 1-й и 2-й тощекишечных артерий; б) основных стволов 2-й тонкокишечной артерии; в) анастомозов между ее ветвями; г) анастомозов между ветвями 2-й и 3-й тощекишечных артерий; д) анастомозов между ветвями 3-й артерии; г) анастомозов между 3-й и 4-й артериями. По А.А.Русанову, наиболее часто встречаются 2 варианта ветвления 1-го аорнального сосуда, благоприятствующие формированию трансплантата, а также 2 варианта ветвления 2-го сосуда (рисунок 1, а—г).
Если обнаружен достаточно мощный анастомоз между 1-й и 2-й артериями, как это указано на рис. 63, приступают к их обнажению. Рассекают оба брюшинных листка над сосудами, тщательно предохраняя их от травмы (особенно вены, которые тонки и непрочны), рассекают и час тично иссекают клетчатку. При этом встретившиеся лимфатические узлы аккуратно удаляют, перевязывая питающие их мелкие сосуды во избежание неприятного кровотечения, затрудняющего дальнейшие этапы операции. Перед перевязкой радиальных сосудов и их ветвей всегда выполняют пробное пережатие с помощью мягких сосудистых зажимов, как можно дальше от развилки (рисунок 2).

В области проксимального конца планируемого трансплантата мягкий сосудистый зажим кладут на аркаду в поперечном направлении по отношению к длиннику кишки. Оценивают адекватность кровоснабжения будущего проксимального конца трансплантата. Если видимая пульсация во всех ветвях 1-й артерии исчезает, кишка начинает синеть и теряет тонус, приходится отказываться от включения этого участка кишки в трансплантат.
При обследовании 2-го радиального сосуда необходимо выяснить, надо ли перевязывать его основной ствол или можно ограничиться перевязкой ветвей, что предпочтительнее для формирования трансплантата наибольшей длины. При 1-м варианте ветвления 2-го еюнального сосуда (рисунок 1, в, г) перевязка его ветвей и обеспечение кровотока по вторичным аркадам вполне возможны. Если есть необходимость, так же перевязывают более дистальные сосуды или их ветви. Таким образом, в зависимости от длины выкраиваемого изоперистальтического трансплантата, количества и ширины аркад основным питающим сосудом чаще оказываются 3-я и 4-я, реже — 5-я радиальные кишечные артерии.
Необходимую длину трансплантата (при субтотальной эзофагопластике — от устья основного питающего сосуда в корне брыжейки до угла нижней челюсти) измеряют, укладывая нить или тесьму вдоль сосудистых аркад. Для упрощения этой процедуры предварительно рассекают брюшинные листки вдоль аркад или в виде трилистников, отступя от сосудов примерно на 1,5 см.
При удовлетворительном кровоснабжении проксимального конца будущего трансплантата артерии и вены брыжейки, освобожденные от брюшины и клетчатки, пересекают между зажимами отдельно друг от друга и как можно дальше от развилок между аркадами, чтобы не нарушить кровоток по ним. В то же время необходимо иметь в виду, что радиальные сосуды могут ветвиться очень близко к основным стволам верхней брыжеечной артерии и вены, которые необходимо также тщательно оберегать от травмы. Поэтому большое значение имеет использование специального, очень точного и надежного инструментария (зажимы, пинцеты, ножницы), позволяющего исключить соскальзывание лигатур или зажимов и любую травму питающих кишку сосудов. Затем пересекают кишку в проксимальной ее части в намеченном месте (при использовании 1-й тощекишечной артерии проксимальный конец кишки может быть весьма коротким — всего несколько сантиметров). Аборальный конец кишки ушивают. У основания трансплантата накладывают Y- образный анастомоз по типу «конец в бок».
После этого формируют загрудинно-предфасциальный (или подкожный) канал от мечевидного отростка до яремной вырезки грудины с помощью ложек С.С.Юдина. Не следует пытаться формировать загрудинный тоннель рукой: это часто приводит к повреждению медиастанальных плевральных листков. При использовании ложек С.С.Юдина такое осложнение встречается очень редко.
В других случаях (после предварительного трансхиатального удаления пищевода) тонкокишечный трансплантат обычно планируют провести на шею через заднее средостение. Наконец, не исключен вариант и внутри-плевральной сегментарной пластики пищевода. Перед проведением трансплантата на шею его сосудистую ножку (брыжейку) фиксируют 1— 2 швами к апоневрозу в области правого края лапаротомной раны, чтобы предотвратить перекрут.
Разрезом параллельно и кпереди от левой кивательной мышцы обнажают пищевод на шее. Выводят в рану трансплантат и формируют эзофагоеюноанастомоз по одной из подходящих методик: «бок в бок» при отсутствии «слепого мешка» пищевода, «конец в конец» или «конец в бок» с пересечением пищевода и ушиванием его аборального конца, если имеется опасность образования «слепого мешка» собственного пищевода.
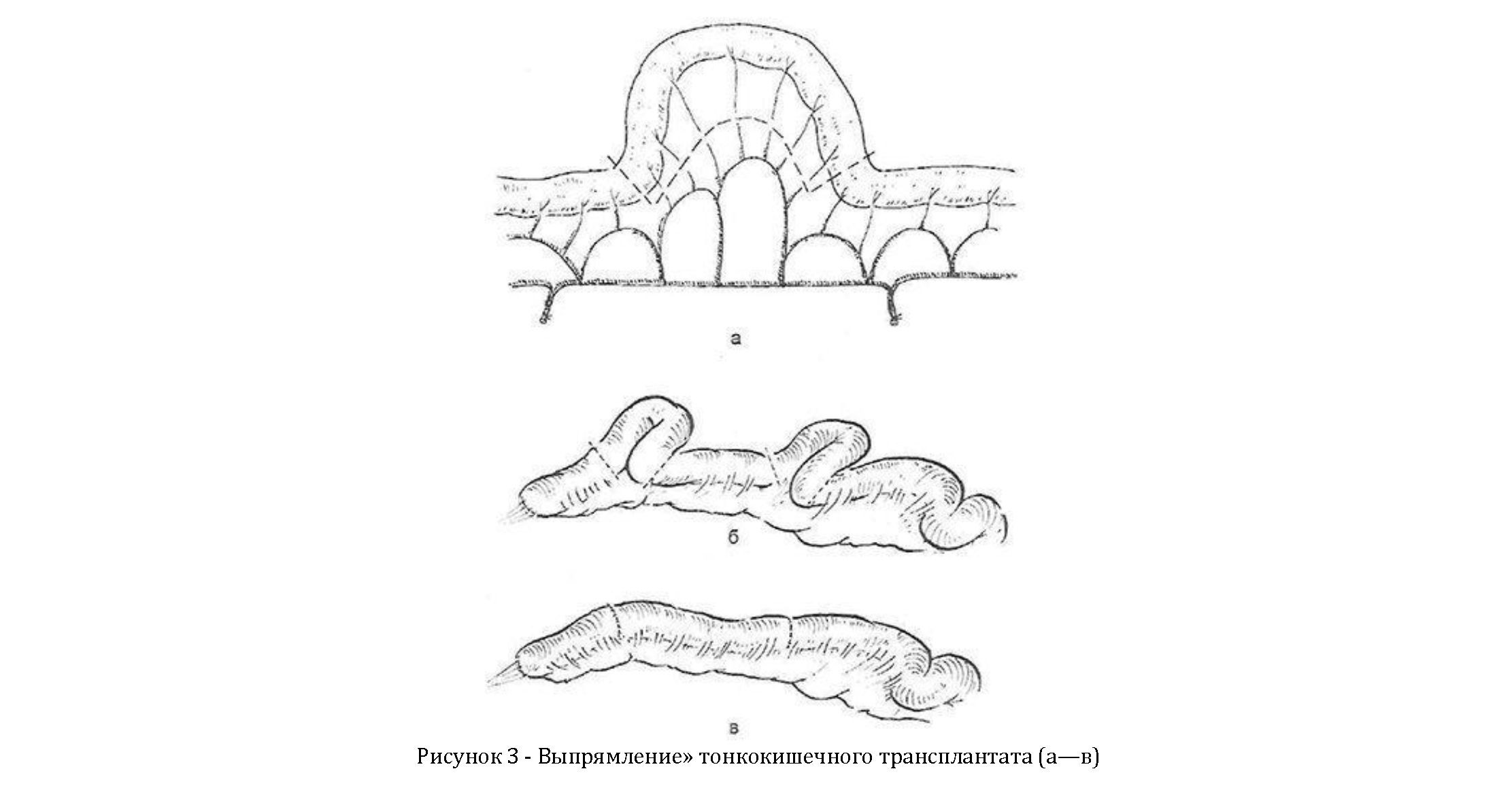
При большом количестве избыточных кишечных петель, препятствующих проведению трансплантата на шею, их резецируют, пересекая только короткие сосуды, тщательно предохраняя от травмы сосудистые аркады. Таким образом, ткани кишки и сохраняется сосудистое русло (рисунок 3, а— в).
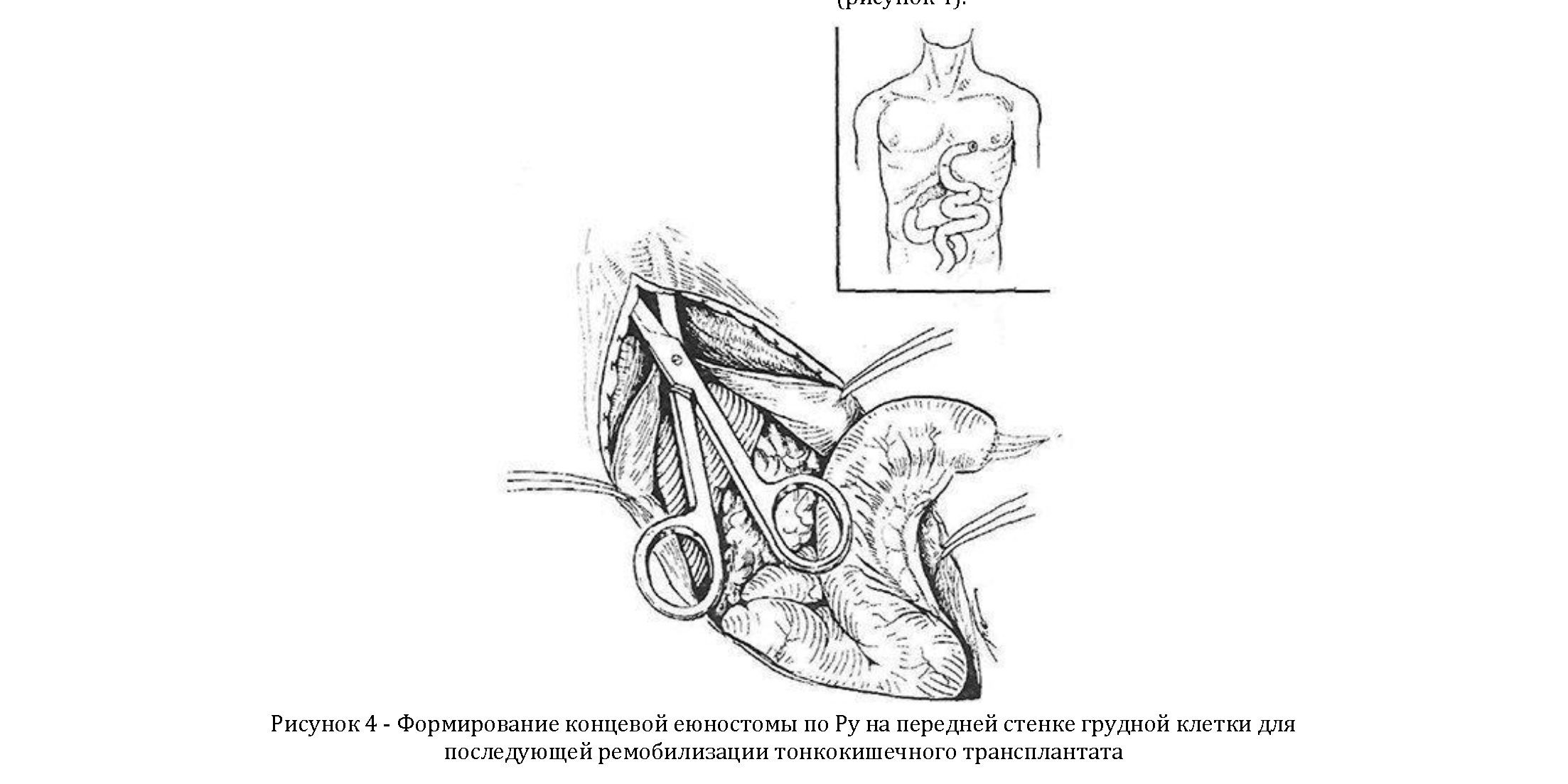
При недостаточной для наложения анастомоза на шее длине тонкокишечного трансплантата его укладывают под кожу трансплантат «выпрямляется», что значительно улучшает пассаж пищи и в определенной степени кровоснабжение верхнего конца трансплантата, так как уменьшается масса груди, выводя проксимальныи конец как можно выше в виде концевой аностомы для того, чтобы в последующем (через 3—4 мес) выполнить ремобилизацию трансплантата ſTЛĪ/ГГVĪJГ∩ĪГ Дì
В зависимости от того, до какого уровня под кожей груди удалось довести тонкокишечный трансплантат, а также от протяженности ожоговой стриктуры ремобилизация и завершение 2-го этапа эзофагопластики могут быть выполнены различно.
Так, если трансплантат доведен до грудиноключичного сочленения, а пишевод обожжен почти весь или полностью, делают один большой разрез от уровня перстневидного хряща трахеи книзу, сначала параллельно и кпереди от левой кивательной мышцы, затем по средней линии груди и живота с обходом пупка слева (первый вариант). Выделяют трансплантат из сращений острым путем, стараясь не повредить питающих со судов. Обязательно необходимо выделить трансплантат из спаек в брюшной полости (рисунок 5).
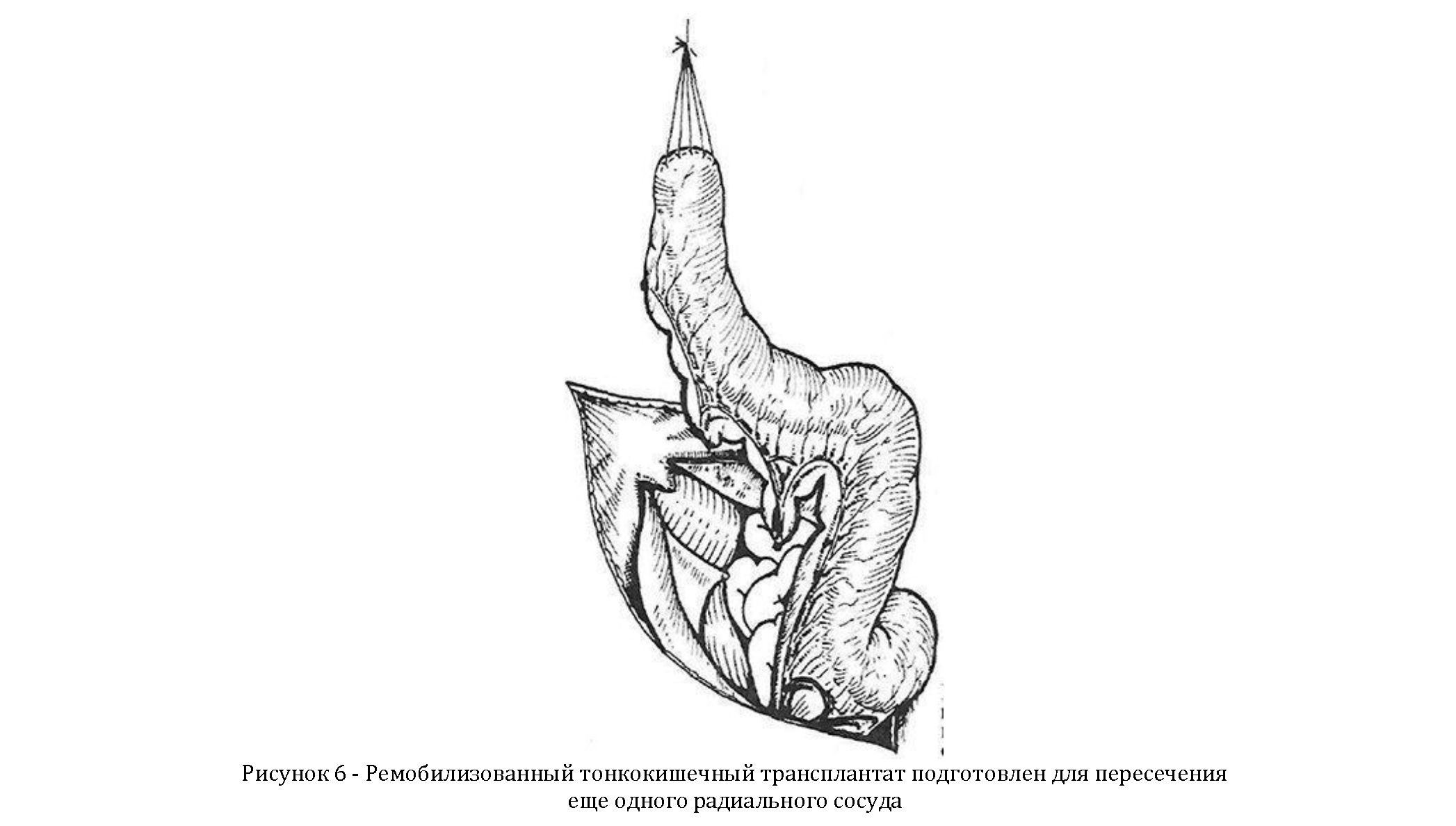
Этот прием позволяет, как правило, удлинить его настолько, чтобы можно было завершить пластику. Если длина трансплантата после предпринятых мер остается недостаточной для наложения анастомоза на шею (со временем выкроенная кишка и ее брыжейка, как известно, всегда удлиняются), то, проведя пробное пережатие, убедившись в адекватности кровоснабжения трансплантата, пересекают и перевязывают еще один радиальный сосуд в брыжейке тощей кишки (рисунок 6).
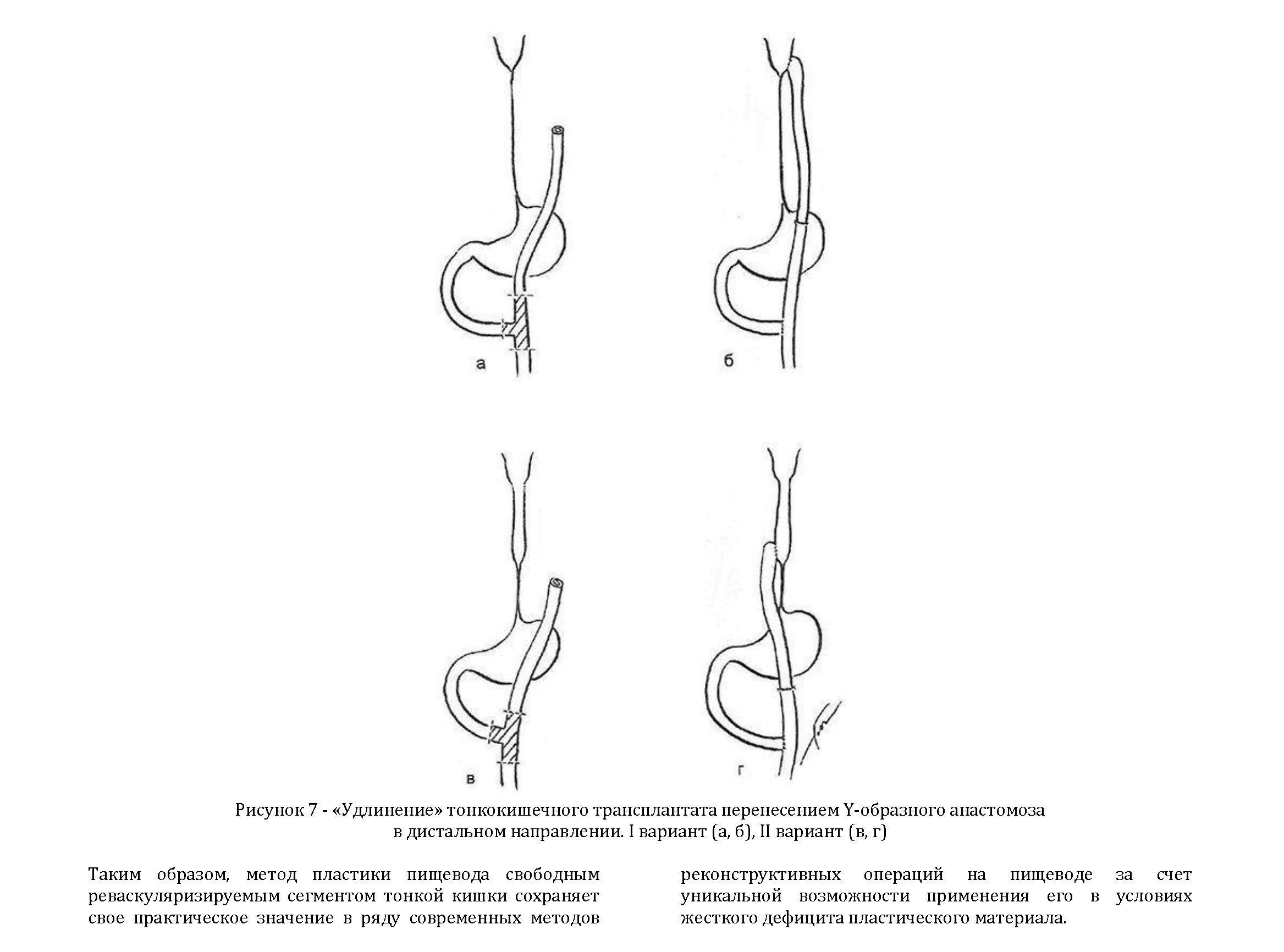
Подтягиванию трансплантата на шею может помешать слишком высоко сформированный Y-образный еюноеюноанастомоз. В таких случаях анастомоз резецируют, проходимость тощей кишки восстанавливают анастомозом «конец в конец» и накладывают новый Y- образный еюноеюноанастомоз (рисунок 7, а, б).
В других случаях, когда трансплантат доведен при предыдущей операции только до середины тела грудины, разрез книзу начинают с этого уровня, а на шее делают отдельный разрез для доступа к пищеводу. Трансплантат ремобилизуют, как было указано выше. Между двумя разрезами кожи и подкожной жировой клетчатки формируют тоннель и соединяют трансплантат с шейным отделом пищевода (рисунок 7, в, г).
СПИСОК ЛИТЕРАТУРЫ
- Бакиров А.А. Тонкокишечная пластика пищевода // Грудная и сердеч,-сосудистая хирургия. - 2000. - №6. - С. 65-66.
- Бакиров А.А. Хирургическое лечение ожоговых стриктур пищевода // Грудная и сердеч.-сосудистая хирургия. - 2000. - №4. - С. 45-49.
- Горбунов Г.Н., Мариничев В.Л., Волков О.Н. Модифицированный способ пластики пищевода тонкокишечным аутотрансплантатом // Вестник хирургии. - 1990. - Т.145, №10. - С. 109-111.
- Кобак М.Э. Методы изучения жизнеспособности трансплантатов для пластики пищевода // Вестн. хирургии. - 1993. - Т.150, № 1 -2. - С. 142-145.
- Мариничев В.Л. Эзофагоеюнопластика с использованием микрохирургической техники у больных раком грудного отдела пищевода: Автореф. дис. ... канд.мед.наук - СПб., 1996. - 21 с.
- Мумладзе Р.Б., Бакиров А.А. М.И. Эзофагогастропластика при стриктурах пищевода // Анналы хирургии. - 2000. - №6. - С. 31-34.
- Мустафин Д. Г., Злыгостев П. Н., Воробьев А. И. и др. Выбор и результаты эзофагопластики при раке пищевода // Грудная и сердеч.-сосудистая хирургия. -1995. - №1. - С. 63-65.
- Черноусов А.Ф., Андрианов В.А., Домрачеев С.А., Богопольский П.М. Опыт 1100 пластик пищевода // Хирургия. - 1998. - №6. - С. 4-6.
- Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. Хирургия пищевода. - М.: « Медицина», 2000. - 349 с.
- Fisher S., Cameron R., Hoyt D. Free jejunal interposition graft for reconstruction of the esophagus // Head. Neck. - 1990. - Vol.12, № 2. - P.l 26-130.
- Germain M.A., Demers G., Launois B. et al. Salvage esophagoplasty using free jejunal transplant after repeated failure of other esophagoplasties. 25 cases // Chi-rurgie. - 1994. - Vol. 119, № 10. - P. 672-680.