Данная статья рассматривает изучение частоты генотипов и аллелей генов про- и противовоспалительных цитокинов (TNF-α, IL-10, IL-6) у больных острым инфарктом миокарда с подъемом сегмента ST (ИМпST) с целью определения группы риска развития осложненного течения ИМпST.
Полиморфизм генов цитокинов исслеДовали методом рестриктного анализа продуктов амплификации специфических участков генома у 59 (72,8%) мужчин и 22 (27,2%) женщин, казахской национальности. Контролем служила группа из 100 практически здоровых лиц (доноры казахской национальности). У всех исследовался оДнонуkл℮оtиДный SNP-полиморфизм промоторного региона генов TNF-α (G–308A), IL-10 (G-1082A), IL-6 (G-174C). Диагноз ИМпSTустанавливали в соответствии с классификацией Европейского общества кардиологов (ESC). Все больные были разделены на 2 группы, гД℮ группу неосложненного течения ИМпST составили 49 (60,5%) больных, которые не имели осложнений, как в госпитальном периоде, так и после неё. Вторую группу составили 32 (39,5%) пациентов с осложненным течением ИМпST.
В работе показана, ассоциация гомозиготного генотипа минорного типа А/А в позиции G–308A промоторной области гена TNFα с осложненным течением ИМпST (OR=6,89, 95 %, р<0,05). Выявлено, что гомозиготный генотип минорного типа С/С в позиции G-174C промоторной области гена IL-6 также ассоциировал с осложненным течением ИМпST (OR=4,60, 95%, р<0,05). Согласно нашим данным, не было выявлено существенных различий в частоте аллелей и генотипов полиморфизма G-1082A гена IL-10 в зависимости от течения ИМпST. Таким образом, полиморфизмы генов цитокинов можно было бы рассматривать как возможный генетический фактор риска развития осложненного течения ИМпST у больных казахской национальности (ВосточноКазахстанской области Республики Казахстан), после дополнительных исследовании с существенным увеличением объема выборки
По данным Всемирной организации здравоохранения (ВОЗ) сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти во всем мире: ни по какой другой причине ежегодно не умирает столько людей, сколько от ССЗ [1]. Так ежегодно от CCЗ в мире умирают около 17,5 млн. человек, что составляет около 30 % от всех случаев смерти в мире, из них более 7 миллионов человек умирают вследствие ишемической болезни сердца (ИБС), что составляет 12,8% от всех случаев смерти [1]. Основной причиной смертности являются заболевания сердца, в частности ИБС, основное проявление которой - инфаркт миокарда (ИМ) [2,3]. Особую драматичность течение ИБС приобретает при развитии инфаркта миокарда с подъемом сегмента ST (ИМпST), что заставляет кардиологов мира искать новые возможности как первичной, так и вторичной его профилактики [4].
Один из подходов к профилактике ИМ и его осложнений - изучение генов, обусловливающих предрасположенность к заболеванию. Генетические ассоциативные исследования и анализ генов-кандидатов позволили выявить ряд полиморфизмов, предрасполагающих к развитию острых коронарных событий [5]. Данные последних исследований указывают на важную роль цитокиновой сети в инициации и прогрессировании атеросклеротического процесса и ИБС. В то же время изучение значимости полиморфизма генов цитокинов в развитии ИМ ограничено немногочисленными работами. Между тем, комбинация результатов генетического тестирования с традиционными факторами риска может значительно повысить их прогностическую ценность в развитии и течении ИМ.
Среди цитокинов основное значение придается интерлейкинам с провоспалительной активностью - интерлейкин-6 (IL-6), фактор некроза опухолей-a (TNF-α). Нарушение метаболизма TNF-α, играет определенную роль в развитии сердечно-сосудистых нарушений [6,7]. TNF-α, один из основных цитокинов воспаления, продуцируется макрофагами миокарда, миоцитами сердца и лимфоцитами и обладает значительной биологической активностью [8].
Гены интерлейкинов обладают чрезвычайно высокой степенью полиморфизма, причем количество участков этого полиморфизма в одном гене может достигать нескольких десятков и располагаться они могут как в кодирующих экзонах, так и в интронах и, что особенно важно, в промоторных регуляторных зонах структуры гена. Для исследования выбраны 3 гена-кандидата, которые, согласно международным базам данных, ассоциируются с ИБС и ИМ: гены провоспалительных цитокинов IL-6, TNF-α и противовоспалительного интерлейкина-10 (IL-10). На основании этих данных был выбран полиморфный маркер (G-1082A) гена IL-10, который расположен в промоторе гена и, возможно, ассоциирован с уровнем синтеза интерлейкина [9] и полиморфный маркер (G-174C) гена IL-
Несмотря на множество описанных возможных полиморфизмов гена TNF-α, лишь замена в позиции G -308A влияет на изменение транскрипции и продукции цитокина [10]. Наличие аллельного полиморфизма в промоторных участках генов интерлейкинов обеспечивает разнообразие индивидов по степени продукции цитокинов при антигенной стимуляции, т.е. при формировании воспалительных клеточных реакций, в том числе и при остром инфаркте миокарда. В развитие этой концепции нами проведен анализ частоты встречаемости отдельных аллелей ряда генов интерлейкинов, расположенных именно в промоторных участках генов.
Цель работы - изучить частоты аллельных вариантов и генотипов гена цитокинов (TNF-α, IL-10, IL-6) у больных острым инфарктом миокарда с подъемом сегмента ST (ИМпST).
Материалы и методы. Нами обследованы 81 больных ИМпST находящиеся на лечении в кардиологическом отделении Медицинского Центра Государственного Медицинского Университета г.Семей. В исследование включены 59 (72,8%) мужчин и 22 (27,2%) женщин, казахской национальности, средний возраст пациентов составил 62,8 (40; 91) лет. Контрольную группу составили 100 практически здоровых лиц (доноры казахской национальности), этнически и географически соответствующие исследуемой группе пациентов. Кроме того, учитывая, что внешние факторы значимы при развитии сердечно-сосудистых заболеваний (ССЗ), контрольная группа была набрана из лиц проживающих в
Восточно-Казахстанской области, сопоставимых по полу и возрасту. Диагноз ИМпST устанавливали в соответствии с классификацией Европейского общества кардиологов (ESC). Все пациенты в стационаре получали стандартную медикаментозную терапию. У всех больных исследовался однонуклеотидный SNP-полиморфизм промоторного региона генов TNF-α (G–308A), IL-10 (G-1082A), IL-6 (G- 174C). Генотипирование промоторных участков цитокинов проводили на основании данных о нуклеотидной последовательности исследуемых генов из базы данных Gen Bank www.ncbi.nlm.nih.gov/genbank/ с использованием регистрационных номеров TNF-α G-308A (rs1800629), IL-10 G-1082A (rs1800896), IL-6 G-174C (rs1800795). Определение полиморфизмов генов IL-10, TNF-α, осуществляли методом ПЦР с флуоресцентной схемой детекции результата в режиме реального времени (real-time PCR), полиморфизмов гена IL-6, осуществляли методом ПЦР с электрофоретической схемой детекции результата (с аллель-специфичными праймерами, синтезированными в НПФ «Литех», Россия). ДНК выделяли из лейкоцитов периферической крови с использованием стандартных методик. В исследование не включались пациенты с острыми воспалительными, иммунопатологическими, онкологическими заболеваниями, также хроническими заболеваниями в стадии декомпенсации. Исследования выполнены в соответствии с Хельсинской декларацией. Получено заключение этического комитета ГМУ г.Семей от 13.11.2013г. №2. У вcex учacтникoв былo пoлучeнo пиcьмeннoe инфoрмирoвaннoe coглacиe на участие в исследовании. В течении последующих 12 месяцев со дня поступления, проведена оценка наличия конечных точек: жив/умер, острая сердечная недостаточность III–IV стадия по Killip, декомпенсацией ХСН, постинфарктная аневризма левого желудочка, ранняя постинфарктная стенокардия, рецидивирующий инфаркт миокарда, прогрессирующая стенокардия (с рестенозом в зоне стента), тяжелые нарушения ритма и проводимости.
Все больные были разделены на 2 группы. Группу неосложненного течения ИМпST составили 49 (60,5%) больных, которые не имели осложнений, как в госпитальном периоде, так и после неё. Вторую группу составили 32 (39,5%) пациентов с осложненным течением ИМпST (таблица 1).
|
Показатель |
Госпитальный период |
Постгоспитальный период |
|
Ранняя постинфарктная стенокардия |
17,2% (14) |
12,3% (10) |
|
Сердечная недостаточность III -IV стадия по Killip |
12,3% (10) |
- |
|
Хроническая сердечная недостаточность III -IV ФК по NYHA |
- |
22,2% (18) |
|
Развитие подострой аневризмы левого желудочка |
4,9% (4) |
4,9% (4) |
|
Летальный исход |
8,6% (7) |
7,4% (6) |
|
Рецидивирующий инфаркт миокарда |
- |
11,11% (9) |
|
Клинически значимые нарушения ритма |
6% (5) |
17% (14) |
|
Прогрессирующая стенокардия (с рестенозом в зоне стента) |
- |
4,9% (4) |
Таблица 1 - Частота
конечных точек в течении 12 месяцев
|
Точки полиморфизм а генов |
Генот ипы |
Группы |
χ 2 |
p-value |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Неосложненное течение (n-49) |
Осложненное течение (n-32) |
Контрольная группа (n-100) |
|||||||||
|
n |
частота % |
OR* |
n |
частота % |
OR* |
n |
частота % |
||||
|
TNF-α G-308A |
G/G |
31 |
63,26 |
1,84 |
11 |
34,37 |
0,54 |
78 |
78,0 |
30,52 |
0,001 |
|
G/A |
16 |
32,65 |
0,87 |
12 |
37,50 |
1,14 |
21 |
21,0 |
|||
|
A/A |
2 |
4,08 |
0,14 |
9 |
28,12 |
6,89 |
1 |
1,0 |
|||
|
G |
78 |
79,59 |
1,50 |
34 |
53,12 |
0,66 |
177 |
88,5 |
|||
|
A |
20 |
20,41 |
0,43 |
30 |
46,87 |
2,29 |
23 |
11,5 |
|||
|
IL-10 G-1082A |
G/G |
19 |
38,77 |
1,24 |
10 |
31,25 |
0,80 |
52 |
52,0 |
15,40 |
0,003 |
|
G/A |
24 |
48,98 |
1,04 |
15 |
46,87 |
0,95 |
46 |
46,0 |
|||
|
A/A |
6 |
12,24 |
0,55 |
7 |
21,87 |
1,79 |
2 |
2,0 |
|||
|
G |
62 |
63,26 |
1,16 |
35 |
54,69 |
0,86 |
150 |
75,0 |
|||
|
A |
36 |
36,73 |
0,81 |
29 |
45,31 |
1,23 |
50 |
25,0 |
|||
Таблица 2 - Особенности распределения генотипов и аллелей по полиморфизмам TGF-α (G-308A), IL-10 (G-1082A) и IL-6 (G-174C) у больных ИМпST и здоровых лиц. Ассоциация полиморфизмов с течением ИМпST
Частота осложнений ИМпST в период нашего наблюдения (12 месяцев) регистрировалась, как в госпитальном периоде, так и в постгоспитальном периоде.
Полученные данные обрабатывались с использованием программы SPSS Inc., версия 20.0. Статистическая обработка результатов исследований включала расчет таких показателей, как частота встречаемости генотипов и аллелей генов их комбинаций, отношение шансов (OR – odds ratio) с расчетом 95 % доверительного интервала (95 % Confidence Interval – 95 % CI). Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди–Вайнберга. Достоверность различий частот распределения изучаемых признаков в альтернативных группах определяли по критерию χ 2 (точный двусторонний тест Фишера).
Результаты и обсуждение.
В ходе анализа выполненных молекулярно-генетических исследований установлено, что частота генетического полиморфизма G-308A гена TNF-α у 78,0% резидентов контрольной группы наблюдалось G/G - состояние аллелей, расцененное как гомозигота дикого типа, у 21,0% резидентов – G/A, гетерозигота соответственно, у 1% резидентов – А/A, расцененное как гомозигота минорного типа. Частота генетического полиморфизма G-1082A гена IL-10 у 52,0% резидентов контрольной группы наблюдался генотип – G/G, у 46,0% резидентов - гетерозигота, у 2% резидентов – А/A. Частота генетического полиморфизма G- 174C гена IL-6 у 64,0% резидентов контрольной группы наблюдался генотип – G/G, у 35,0% резидентов - гетерозигота, у 1% резидентов – С/С (таблица 2).
Анализ распределения генотипов TNF-α G-308A в исследуемой нами группах выявил преобладание частоты гомозиготного варианта дикого типа в группе неосложненного течения составил 63,26%, над группой осложненного течения 34,37%. Как видно, и данных таблицы, в распределения генотипов TNF-α преобладание гомозиготного -308G/G варианта над гетерозиготным - 308G/А в группах неосложненного течения и контрольной группе. Частота распределения гомозиготного варианта минорного типа -308А/А преобладает в группе осложненного течения 28,12%, относительно группы неосложненного течения 4,08 % (OR=6,89, 95%, р<0,05). Полученные нами результаты перекликаются с работами ряда авторов [11]. Показана ассоциация генотипов -308A/A и -308A/G гена TNF-α с повышенным риском развития неблагоприятного исхода в группе больных, перенёсших острый коронарный синдром [11].
Примечание: * в сравнении с группами течения ИМпST
|
IL-6 G-174C |
G/G |
38 |
77,55 |
1,65 |
15 |
46,87 |
0,60 |
64 |
64,0 |
17,83 |
0,001 |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
G/С |
9 |
18,37 |
0,53 |
11 |
34,37 |
1,87 |
35 |
35,0 |
|||
|
С/С |
2 |
4,08 |
0,21 |
6 |
18,75 |
4,60 |
1 |
1,0 |
|||
|
G |
85 |
86,73 |
1,35 |
41 |
64,06 |
0,73 |
163 |
81,5 |
|||
|
С |
13 |
13,26 |
0,36 |
23 |
35,94 |
2,71 |
37 |
18,5 |
Как видно, из данных таблицы частота распределения генотипов IL-10 G-1082A выявил преобладание гомозигот дикого типа -1082 G/G - 38,77%, относительно частоте гомозигот минорного типа -1082А/А - 12,24% в группе неосложненного течения. Однако и в группе осложненного течения частота распределения гомозигот дикого типа 1082 G/G - 31,25%, также превышает частоту гомозигот минорного типа -1082А/А -21,87%.
Распределения частот генотипов IL-6 G-174C в исследуемых группах выявил сравнительно высокую частоту гетерозигот -174G/C - 34,37% и гомозигот минорного типа -174С/С (18,75%) в группе осложненного течения относительно группы неосложненного течения. Где частота гомозигот дикого типа -174G/G - 77,55% выше частоты гомозигот минорного типа -174С/С - 4,08% и гетерозигот -174G/C - 18,37%. Данные анализа частоты носительства исследуемых позиций промоторного региона генов IL-6 при ИМпST показали, что гомозиготность минорного типа -174С/С способствовала развитию осложненного течения (OR=4,60, 95%, р<0,05). При анализе влияния полиморфизма G-174С промоторного региона гена IL-6 на течение ИМпST наблюдаеся снижение риска развития осложненного течения у носителей гомозиготного варианта дикого типа - 174G/G (OR = 1,65, 95 %, р<0,05). Наши данные частично перекликаются с работами ряда авторов, которые выявили ассоциации функционального полиморфизма G-174С гена IL6, как с классическими факторами риска ССЗ, так и с риском развития ИМ [12].
Согласно нашим данным, частота распределения аллелей A полиморфного варианта G-308A гена TNFα в группе осложненного течения (46,87%) в 2 раза превышали частоты аллелей в группе неосложненного течения (20,41%) и в 4 раз превышал в контрольной группе (11,5%), что возможно повлияло на течение заболевания. В то же время частота распределения аллелей G в исследуемых группах, статистически значимо не отличались (р=0,083) рисунок 1.
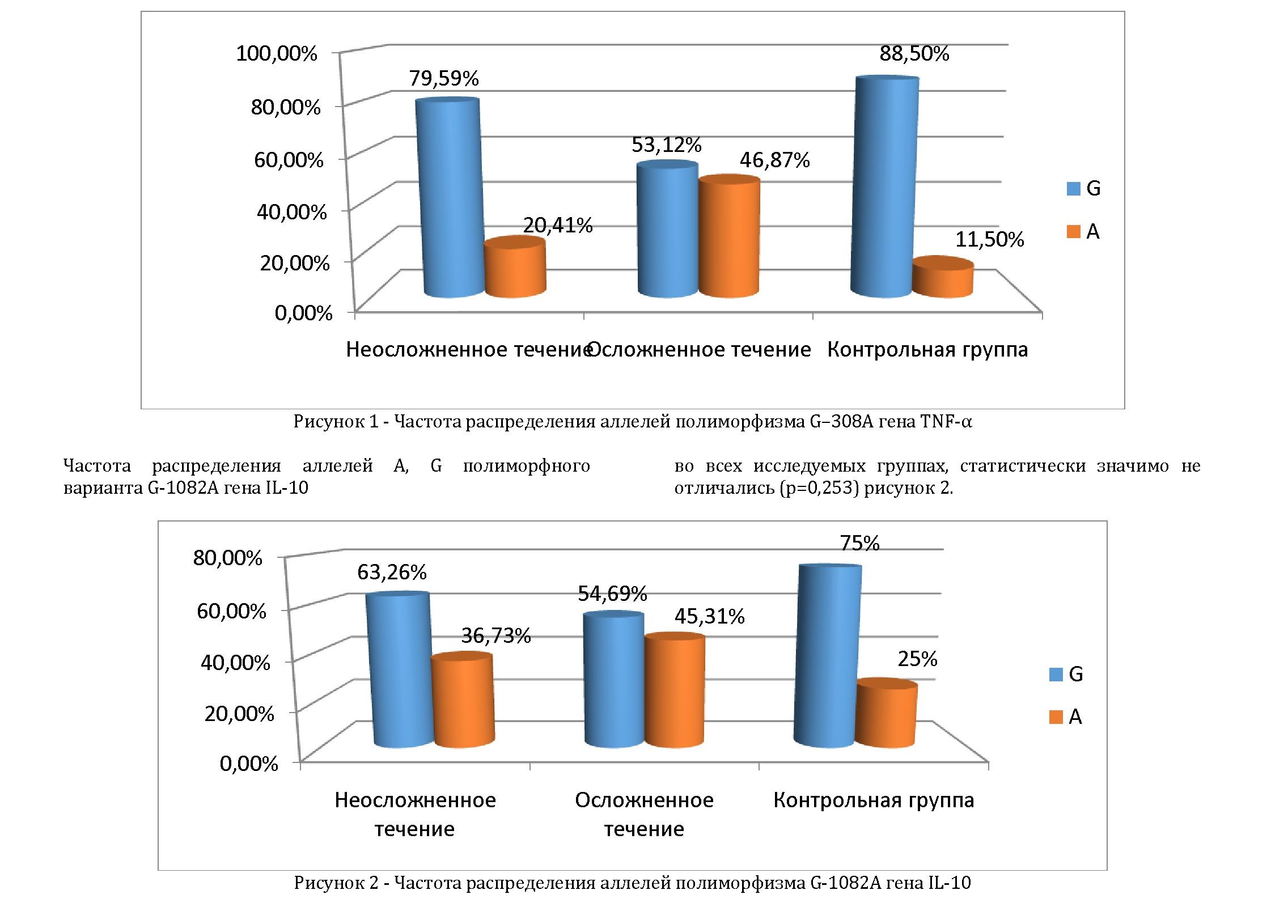
Частота распределения аллелей C полиморфного варианта G-174C гена IL-6 в группе осложненного течения (35,94%) почти в 3 раза превышали частоты аллелей в группе неосложненного течения (13,26%) и в 2 раз превышал в контрольной группе (18,50%), что возможно повлияло на течение заболевания. В то же время частота распределения аллелей G в исследуемых группах, статистически значимо не отличались (р=0,174) рисунок 3.
Таким образом, гомозиготный генотип минорного типа - 308А/А гена TNFα G-308A, гомозиготный генотип минорного типа -174С/С гена IL-6 G-174C, можно было бы рассматривать как возможный генетический фактор риска развития осложненного течения ИМпST у больных казахской национальности. Однако данный результат следует признать сугубо предварительным, так как для подтверждения или опровержения полученных результатов необходимо существенно увеличить объемы выборок.
Согласно нашим данным, не было выявлено существенных различий в частоте аллелей и генотипов G-1082A полиморфизма гена IL-10 в зависимости от течения ИМпST, что требует дальнейших исследований со значительным увеличением числа испытуемых в каждой группе.
В анализе особенностей частоты распределения аллелей, выявлено, что аллель G полиморфного варианта G-308A гена TNFα, аллель G полиморфного варианта G-1082A гена IL-10, также аллель G полиморфного варианта G-174C гена IL-6 встречаются существенно чаще во всех исследуемых группах (рисунки 1,2,3). Так же, следует отметить что аллель А полиморфного варианта G-308A гена TNFα, аллель А полиморфного варианта G-1082A гена IL-10, также аллель С полиморфного варианта G-174C гена IL-6 встречаются существенно чаще в группе осложненного течения. Однако статистически значимых различии не выявлено (р>0,05).
Выводы:
Итак, основным результатом настоящей работы можно считать выявление 2 генотипов, генотипа А/А полиморфных вариантов G-308A гена TNFα, генотипа С/С полиморфных вариантов G-174C гена IL-6 ассоциированных с осложненным течением ИМпST. Которые возможно свидетельствуют о вкладе данного полиморфизма в прогнозировании течения ИМпST у больных казахской национальности Восточно-Казахстанской области Республики Казахстан. Однако на данном этапе работы такой прогноз возможен, только после дополнительного исследования с существенным увеличением объема выборки.
Ограничения исследования. Настоящее исследование имеет определенные ограничения, обусловленные малым объемом выборки в исследуемых группах, что является недостаточным для получения статистически значимых закономерностей. Для решения поставленных задач необходимы дальнейшие исследования, с большим объемом выборки, обладающие большей мощностью.
Конфликт интересов
Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Благодарность
Выражаем благодарность всем пациентам и членам их семей, которые участвовали в этом исследовании.
СПИСОК ЛИТЕРАТУРЫ
- http://www.who.int/chp/chronic_disease_report/.
- Thygesen K., Alpert J.S., White H.D. et al. [Перевод Евсеев М.О.] Универсальное определение инфаркта миокарда // Рациональная Фармакотерапия в Кардиологии. - 2008. - №5. - С. 91-105.
- Thygesen K., Alpert J.S., Jaffe A.S. et al. Third universal definition of myocardial infarction // Circulation. - 2012. - Vol. 126. - №16. - P.2020-2035.
- Lev E. I., Komowski R., Vaknin-Assa H. et al. Comparison of the predictive value of four different risk scores for outcomes of patients with ST-elevation acute myocardial infarction undergoing primary percutaneous coronary intervention // Am. J. Cardiol. - 2008. - Vol. 102. - P.6-11.
- J.P. Casas Investigating the genetic determinants of cardiovascular disease using candidate genes and meta-analysis of association risk factors // Intern J Molec Med. - 2007. - Vol. 19. - P. 129-141.
- Skoog T., Dicht W., Boquist S. et al. Plasma tumour necrosis factor α and early carotid atherosclerosis in healthy middle-aged men // Eur. Heart J. - 2002. - Vol. 23. - P. 376-383.
- Young J., Libby P., Schonbeck U. Cytokines in the pathogenesis of atherosclerosis // Thrombosis and Haemostasis. - 2002. - Vol. 88(4). - P. 554-567.
- Meldrum D. R. Tumor necrosis factor in the heart // Amer. J. Physiol. Regul. Integr. Comp. Physoil. - 1998. - Vol. 274. - P. 557-595.
- M. Heiskanen Polymorphism in the IL10 promoter region and early markers of atherosclerosis: The cardiovascular risk in young finns study // Atherosclerosis. - 2010. - Vol. 208. - P. 190-196.
- J. Hoffstedt Excessive fat accumulation is associated with the TNFa -308G/A promoter polymorphism in women but not in men // Diabetologia. - 2000. - Vol. 43. - P. 117-120.
- Humphries S.E., Luong L.A., Ogg M.S., et al. The interleukin-6 -174 G/C promoter polymorphism is associated with risk of coronary heart disease and systolic blood pressure in healthy men // European Heart Journal. - 2001. -V. 22. - P. 2243-2252.