АННОТАЦИЯ
Разработана методика одновременного количественного определения эналаприла и энала- прилата в плазме крови человека методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием.
Ключевые слова: эналаприл, эналаприлат, ВЭЖХ-МС/МС.
Введение:
Эналаприл - лекарственное средство из группы ингибиторов ангиотензинпревращающего фермента. Препарат входит в список ЖНВЛП, широко применяется для лечения артериальной гипертензии и хронической сердечной недостаточности. Эналаприл сам по себе оказывает слабое гипотензивное действие, его активный метаболит - эналаприлат - образуется в организме при гидролизе под действием эстераз печени. Выраженность и длительность гипотензивного действия при приёме эналаприла определяется скоростью его гидролиза до эналаприлата.
Целью работы была разработка методики одновременного количественного определения эналаприла и эналаприлата в плазме крови человека методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Данная методика должна обеспечить проведение терапевтического лекарственного мониторинга (ТЛМ) у больных артериальной гипертензией и их фенотипирование по скорости гидролиза эналаприла для оптимизации фармакотерапии.
Материалы и методы:
Анализ проводили на жидкостном хроматомасс-спектрометре LCMS-8040 фирмы Shimadzu (Япония): система жидкостной хроматографии Nexera с тройным квадрупольным масс-
спектрометром, система ионизации DUIS, позволяющая одновременно использовать электроспрей (ESI) и химическую ионизацию при атмосферном давлении (APCI), система градиентного элюирования, термостат колонок CTO-20AC. Разделение осуществляли на колонке Sinergi Polar RP, 4мкм, 250x4.6мм (Phenomenex, США) в градиентном режиме. Элюент А: 1% муравьиной кислоты / деионизованная вода и элюент В: 1% муравьиной кислоты / ацетонитрил. Скорость потока подвижной фазы - 1 мл/мин. Объем ввода пробы - 10 мкл.
Детектирование вели в режиме мониторинга множественных реакций (MRM). Ионы- предшественники: для эналаприла 349,30 m/z, для эналаприлата 377,20 m/z. Фрагментные ионы для эналаприла: 234,20, 160,10, 130,10 и 117,20 m/z, для эналаприлата - 206,10, 160,10, 134,10, 117,10 m/z.
Пробоподготовку плазмы крови осуществляли путём осаждения белков. Для этого к 400 мкл плазмы добавляли 800 мкл ацетонитрила, встряхивали в течение 1 мин на шейкере Vortex, центрифугировали 15 мин со скоростью 15000 об/мин. Надосадочную жидкость переносили в виалы и помещали их в автосамплер хроматографа.
Результаты и их обсуждение:
Валидация методики выполнена по следующим характеристикам: селективность, линейность, правильность и прецизионность (внутри цикла и между циклами), предел количественного определения, перенос пробы, стабильность растворов [1-3].
Методика соответствует требованиям руководств по всем валидационным характеристикам. На хроматограмме пробы чистой плазмы не наблюдается пиков, соответствующих по временам удерживанию эналаприлу и эналаприлату (Рис. 1 и 2). Наблюдается линейность в диапазоне 5-100 2
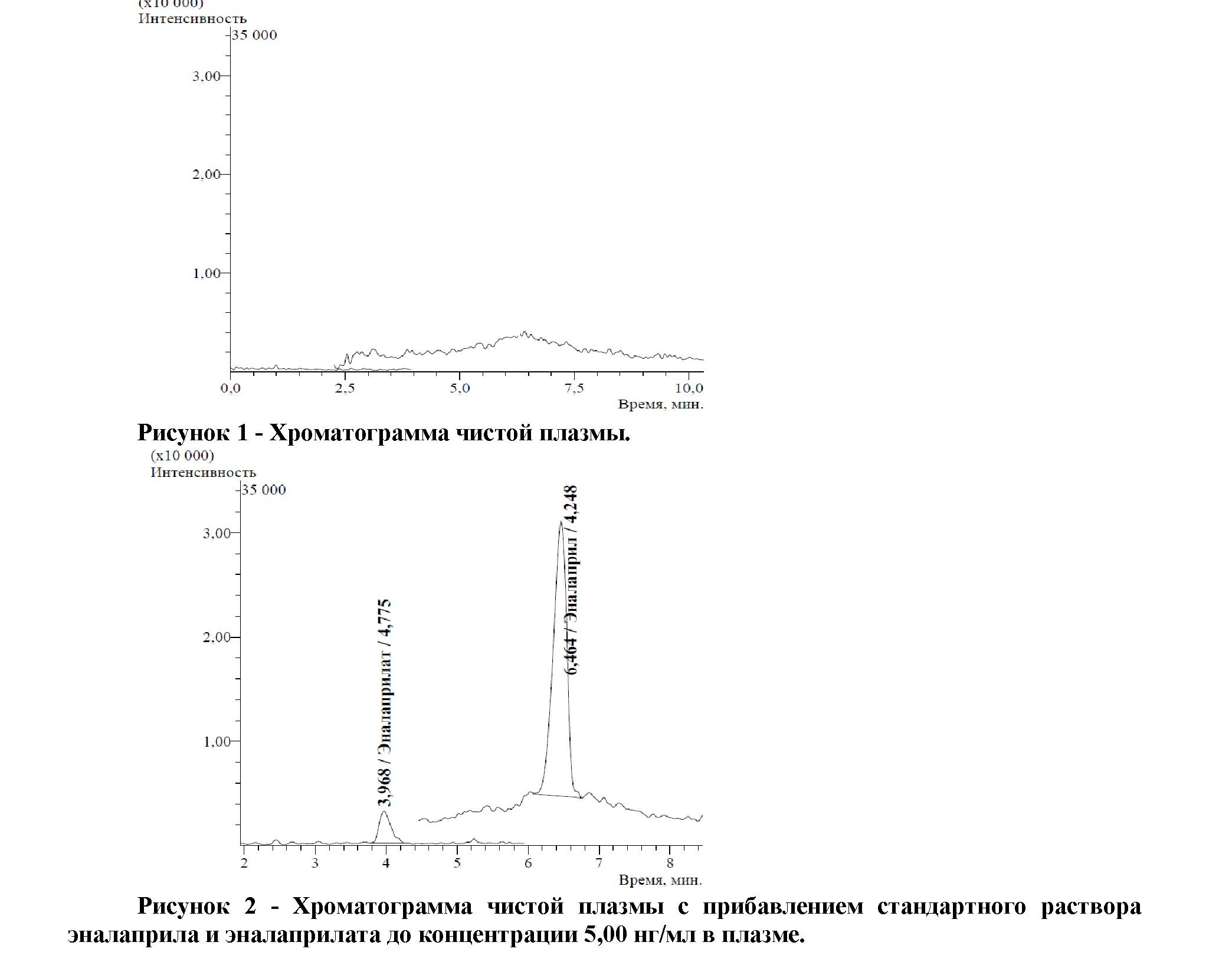
нг/мл для обоих веществ. Уравнения калибровочных прямых для эналаприла и эналаприлата имеют вид y = 83568,3x, r = 0,99985, y = 7125,53x, r = 0,99913, соответственно. Относительное стандартное отклонение среднего результата не превышает 5,67%, относительная ошибка не превышает 9,16%. Подтверждена стабильность стандартных растворов (в течение 14 дней при температуре 2-8оС), кратковременная стабильность (для приготовленных проб в течение 24 ч при анализе на следующий день при температуре 5оС). При последовательном анализе проб с концентрацией эналаприла и эналаприлата 100,00 нг/мл и чистой плазмы на хроматограмме чистой плазмы отсутствовали пики, соответствующие эналаприлу и эналаприлату.
Выводы:
Разработана методика количественного определения эналаприла и эналаприлата в плазме крови человека с помощью метода ВЭЖХ-МС/МС. Проведена валидация методики в соответствии с требованиями современных руководств. Методика может быть применена для проведения ТЛМ и фенотипирования больных по скорости гидролиза эналаприла.
ЛИТЕРАТУРА
- Руководство по экспертизе лекарственных средств. Под. ред. проф. А.Н. Миронова. Том I. - М.: Гриф и К, 2013. - 328 с.
- Guidance for Industry: Bioanalytical method validation. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office: Washington, DC, 2001.
- Guideline on bioanalytical method validation. European Medicines Agency. Committee for medicinal products for human use: London, 2011.