Проблемы анемии в онкологической практике Республики Казахстан (РК) остаются недостаточно актуализированными, что приводит к неДооценке значимости эритропоэтинов (ЭПО) в коррекции анемии в процессе противоопухолевой терапии. Появление на рынке биосимиляров, то есть терапевтических белков, имеющих сопоставимое качество, безопасность и эффективность с оригинальными препаратами, ставит клиницистов переД выбором: биосимиляр или референтный препарат. Недостаточная информированность практикующих врачей о характеристиках новой группы лекарственных среДств биосимилярах при Допуске их в клиническую практику препятствует расширению Доступа пациентов к эффективной терапии. В Данной работе преДставлен краткий и Доступный набор Данных в онкологии и гематологии по оДному из Двух биосимиляров эпоэтина, зарегистрированных и используемых в клинической практике в странах Европейского Союза эпоэтину зета. Данный эпоэтин с 2017 гоДа используется в клинической практике Казахстана.
Введение. Проблемы сопроводительной терапии в клинической онкологии остаются актуальными не только на этапах лечения онкологического пациента, а также в периоды ремиссии и паллиативного ухода. Адекватность и своевременность сопроводительного лечения у больных, получающих противоопухолевую лекарственную терапию, особенно важна, т.к. это сказывается на эффективности лечения в целом.
Одной из серьезных проблем онкологии остается анемия, которая встречается у 67% пациентов, по данным Европейского исследования [1]. Кроме того, риск развития анемии увеличивается с химиотерапией, а выраженность ее зависит как от распространенности процесса, так и интенсивности лечения [2]. По данным Groopman JE, Itri LM (1999), наиболее часто анемия наблюдалась у пациентов, получавших химиотерапию по поводу рака легких и яичников [1, 2]. Известный факт, что развитие анемического синдрома сопровождается ухудшением качества жизни пациента, вызывая чувство усталости, общей слабости, при этом уровень снижения гемоглобина коррелирует споказателем качества жизни (QoL) онкологических больных [3, 4].
Для оценки ситуации в РК по частоте встречаемости анемии у онкологических больных, настороженности врачей при развитии данного синдрома и методов его коррекции в реальной клинической практике, при поддержке Santo Member of Polpharma Group, АО «Химфарм», было проведено ретроспективное исследование на базе двух онкологических диспансеров: Алматинский онкологический центр (г. Алматы) и Жамбылский областной онкологический диспансер (г. Тараз). Проведен ретроспективный анализ 983 историй болезни онкологических пациентов, получивших химиотерапевтическое лечение в центрах РК в 2015 г. Результаты проведенного исследования подробно изложены в статье «Результаты ретроспективного исследования по оценке рутинных подходов в лечении анемии у онкологических больных», опубликованной в журнале «Онкология и радиология Казахстана» в 2018 г. [5]. В данной работе проведен обзор международных рекомендаций терапии анемии у онкологических пациентов, применения биосимиляров эпоэтина в терапии анемии, ассоцированной с химиотерапией, в странах Европы.
Выводы по анализу анемий у онкологичеких пациентов и оценке существующих подходов рутинной терапии. Как показал ретроспективный анализ 983 историй болезни онкологических пациентов, получивших химиотерапевтическое лечение в центрах в 2015 г., в 284 (28,9%) случаях было выявлено снижение гемоглобина в процессе химиотерапии. Основные локализации рака, при которых была диагностирована анемия при цитостатической терапии, следующие: рак молочной железы (27,5%), яичников (19,7%), легких (10,2%), желудка (8,1%), колоректальный рак (4,2%) и лимфомы (3,9%). Данное распределение пациентов больше свидетельствует о частоте и встречаемости самих заболеваний, но никоим образом не отражает риск развития анемического синдрома в зависимости от локализации [5]. В большинстве случаев, 85,9%, анемия ассоциировалась с 6 группами препаратов: платины (цисплатин, карбоплатин, оксалиплатин), антрациклины (доксорубицин,пирубицин), фторпиримидины (5-фторурацил, капецитабин), таксаны (доцетаксел, паклитаскел) и винкаалколоиды (винорельбин, винкристин, винбластин), которые назначалась в различных комбинациях. У четверти пациентов, 25,9%, комбинации химиотерапии включали препараты платины [5]. Одним из ключевых моментов исследования явился анализ коррекции анемии, который показал, что доля больных, которым проводится противоанемическое лечение в процессе противоопухолевой терапии, с анемией 1 степени (Hb 95109 г/л) составляет 23,2%; с доказанной анемией 2 степени тяжести (Hb 80-94 г/л) только 34,2% больным; при уровне гемоглобина ниже 80 г/л (3 степень токсичности) противоанемическая терапия была назначена только половине пациентов (таблица 1). При этом основное лечение анемии 1-ой и 2-ой степени тяжести, ассоциированной с химиотерапией, приходится на препараты железа с преобладанием пероральных форм. Терапия эпоэтинами проводится по мере нарастания степени тяжести анемии, но при этом преобладает назначение терапии в монорежиме [5].
Таблица 1 Назначение корригирующей терапии в зависимости от степени тяжести анемии
|
нет анемии |
анемия 1 степени* |
анемия 2 степени* |
анемия 3 степени* |
|
|
Кол-во больных |
46 |
384 |
152 |
8 |
|
Лечение проведено из них: |
13 (28,3%) |
89 (23,2%) |
52 (34,2%) |
4 (50%) |
|
препаратами железа |
13 (100%) |
68 (76,4%) |
37 (71,1%) |
1 (25%) |
|
эпоэтинами |
- |
11 (12,4%) |
9 (17,3%) |
2 (50%) |
|
сочетание препаратами железа и эпоэтинами |
- |
10 (11,2%) |
6 (11,6%) |
1 (25%) |
* Классификация хронической анемии по степени тяжести ВОЗ
Анализ динамики изменений гемоглобина у больных до улучшения лабораторных показателей красной крови
коррекции и после коррекции на фоне изложенной терапии (рисунок 1).
анемии, ассоциированной с химиотерапией, не показал
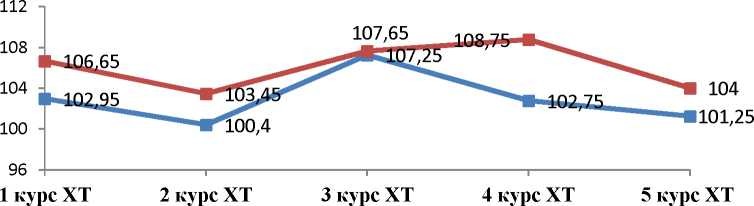
^^—до коррекции ^^—после коррекции
Рисунок 1 Показатели уровня гемоглобина у больных, получающих химиотерапию [5]
Обзор международных рекомендаций терапии анемии у онкологических пациентов. Все актуальные на сегодняшний день международные клинические протоколы рекомендуют эритропоэтины (ЭПО) для лечения или профилактики анемии в онкологии / гематологии на основе доказанной эффективности препаратов по повышению уровня гемоглобина и для уменьшения риска переливания крови [6, 7]. Перед проведением терапии препаратом, стимулирующим эритропоэз, необходимо устранить дефицит железа в организме, при этом отмечается, что пероральные препараты железа больше распространены, но они менее эффективны [6]. При терапии ЭПО без препаратов внутривенного железа уровень ответа на терапию достигает в 50-70% случаях, может отмечаться повышенная потребность в железе. Добавление препаратов внутривенного железа к ЭПО повышает ответ на терапию в 2 раза, достигает до 90%, происходит коррекция железодефицита наряду с этим отмечается значительноеснижение в гемотрансфузиях и улучшается качество жизни [8-16]. При этом, согласно Aapro MS, Link H (2007), использование ЭПО для коррекции анемии ассоцированной химиотерапией гемоглобина <
стимулирующие профилактики и/или лучевой терапии. Важно четко понимать, что целевой устойчивый уровень гемоглобина при лечении ЭПО, должен достигать 120 г/л [6]. До 2016 г. ЭПО в онкологической практике в Казахстане были представлены эритропоэтином альфа, эритропроэтином бета и дарбопоэтином альфа. В настоящее время в список Казахстанского Национального Формуляра и в объем лекарственного обеспечения в рамках государственного объема бесплатной медицинской помощи (ГОБМП) вошел, наряду с изложенными стимуляторами эритропоэза, эпоэтин зета, Эпосан® [17].
начинают
100 г/л.
эритропоэз,
анемии у
при снижении уровня В тоже время агенты, не рекомендуются для пациентов с нормальными значениями гемоглобина до прохождения химиотерапии
Обзор применения биосимиляров эпоэтина в терапии анемии, ассоцированной с химиотерапией, в странах Европы. Известно, что окончание срока патентной защиты на многие оригинальные биопрепараты стало ключевым фактором разработки биосимиляров, которые представляют собой биологические лекарственные препараты, полученные биотехнологическим путем, сопоставимые по параметрам качества, эффективности и безопасности с референтными биологическими агентами [18,19]. Биосимиляр проходит сложный путь одобрения Европейским Медицинским Агентством, в ходе которого должен доказать препаратом, и биопрепаратов сопоставимость с референтным странах Евросоюза применение регулируется специальными законодательными актами Европейского сообщества, национальными законами (например, France Law № 2007248 from 26.02.2007) и подзаконными актами, обязательными для исполнения. Процедура контроля обращения биосимиляров в странах ЕС отвечает принципам централизованной регистрации, соблюдения жестких требований при оценке поданных документов. Препарат сравнения должен иметь регистрацию в ЕС [18, 20-27]. Опыт использования биосимиляров эпоэтина в Евросоюзе (ЕС), является многообещающим, и до сегодняшнего момента не было никаких признаков того, что эти препараты вызывают какой-либо непредвиденный побочный эффект или менее эффективны, чем их инновационные предшественники. [28]. Кроме того, приобретены новые знания и накоплен опыт использования этих препаратов в реальной клинической практике. Так, например, было проведено популяционное исследование Ingrasciotta et al. 2016, у 1003 пациентов с ХБП и онкологических пациентов в Северной Италии, получавших различные СЭ в период с 2009 по 2014 год, включая биосимиляры (эпоэтин зета, эпоэтин альфа биосимиляры; 44,7% пациентов), референтные эпоэтины (эпоэтин альфа; 25,1% пациентов) и эпоэтины, защищенные патентом (эпоэтин бета, дарбэпоэтин альфа, метоксиполиэтиленгликоль-эпоэтин бета; 30,2% пациентов). Результаты данного исследования показали отсутствие статистически значимой разницы в использованных дозировках эпоэтинов как при лечении референтными эпоэтинами, так и патентованными, и биосимилярами, у пациентов с ХБП, и у онкологических пациентов. После трех месяцев лечения от начала лечения все стимуляторы эритропоэза (СЭ) повышали уровень Hb в среднем на 2г/дл (рисунок 2).
патентом
Базовый уровень Нв
Уровень Нв после 3 мдс лечения
Рисунок 2 Влияние на уровень Hb при применении СЭ от базового уровня и через
3 месяца лечения у пациентов с ААХ [29]

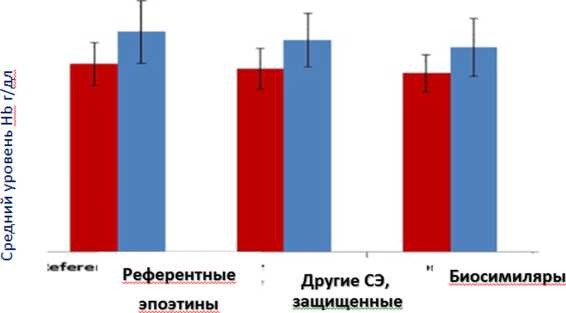

При применении различных типов СЭ не было обнаружено разницы ни в значениях прироста Hb, ни в частоте развития ответа на лечение в категориях: высокий уровень ответа на лечения, средний ответ на лечение и нет ответа на лечение. В среднем, 15-20% пользователей СА не отвечали на терапию. Ни значения дозировок СЭ, ни тип СЭ не послужили предикторами ответа на лечения. Авторами исследования был сделан вывод, что не выявлена разница в клинических исходах терапии анемии как у пациентов с ХБП, так и у онкологических пациентов, в зависимости от того, использовался ли референтный эпоэтин, или же биосимиляр, при том, что использовались сравнимые дозы всех типов эпоэтинов в первые три месяца лечения [29].
Несомненно, биосимиляры способствовали экономической выгоде и стимулированию конкуренции на фармацевтическом рынке [24-26]. Однако для клиницистов важны, в первую очередь, такие проблемы, как эффективность, безопасность и качество лечения. Как уже говорилось ранее, в ЕС и других странах, регуляторные органы разработали четкие нормативные требования к биосимилярам, которые служат гарантом эффективности, безопасности и качества этих продуктов, подтвержденные клиническими исследованиями [25-27]. Внедрение биосимиляров за последние годы вызвало дискуссию о потенциальных рисках безопасности, связанных с переводом на эти продукты и из них. Было высказано предположение, что переключение может привести к проблемам безопасности.
Проведенный метаанализ обзора данных переключения между человеческими рекомбинантными гормонами роста, эритропоэтинами и гранулоцитарными колониестимулирующими агентами, где авторы проанализировали данные клинических испытаний, базы данных фармаконадзора и провели обзор литературы о частоте переводов между этими продуктами и пришли к заключению, что данные о частоте переводов в клинической практике ограничены при этом отмечено, что наиболее часто переключения встречаются у эритропоэтинов и при этом не обнаружены никакие данные клинических испытаний или постмаркетингового наблюдения, что перевод на различные биотехнологические препараты эпоэтинов и с них приводит к проблемам безопасности. Обзор охватывает как перевод между препаратами новаторов в пределах одного класса продуктов, так и переход к биосимилярам и с них [30].
Эпоэтин зета обзор доказательной базы и опыта применения в Европейском Союзе. Эпоэтин зета — это биосимиляр референтного эпоэтина альфа, получивший одобрение на продажу в ЕС в декабре 2007 года. Препарат имеет такую же аминокислотную последовательность, что и референтный эпоэтин альфа под торговым названием Эпрекс®/ Эрипо®. Препарат получил разрешение на использование в странах ЕС на основании данных регистрационной заявки по качеству, эффективности и безопасности, включающих оценку иммуногенности. На рынке ЕС присутствует под двумя торговыми наименованиями Silapo® и Retacrit® [31]. Препарат Retacrit ® стал первым биосимиляром эпоэтина, получившим одобрение на применение при анемии на фоне цитотоксической терапии Консультативным Комитетом по онкологическим препаратам, Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration FDA, USFDA), Агентства Министерства здравоохранения и социальных служб США 25 мая 2017 года [32].
В Казахстане препарат зарегистрирован под торговым названием Эпосан® [33]. Эпоэтин зета (SB309) в 3-х регистрационных рандомизированных многоцентровых двойных слепых исследованиях в нефрологии (Krivoshiev et al.,2008, Wizemann et al., 2008, Krivoshiev et al.,2010) у 1384 пациентов продемонстрировал эквивалентность в эффективности по отношению к референтному препарату эпоэтину альфа Эпрекс®/ Эрипо® при внутривенном и подкожном введении во время фазы коррекции и фазы поддерживающей терапии при нефрогенной анемии. Сравнение включало оценку по специфическим конечным точкам и по взаимозаменяемости препаратов. Исследования проведены в странах Европейского Союза в соответствии с GCP ICH. В результатах был показан эквивалентный профиль эффективности, не было зафиксировано значимых различий ни в достигнутом уровне Hb, ни в средней дозе эпоэтинов [34,35,36]. В исследований, Krivoshiev et al. [37] дополнительно оценивались сравнительные параметры безопасности и иммуногенности по выявлению наличия эритропоэтин-опосредованных антител. Оценка параметров безопасности показала, что нет свидетельств для дополнительных сомнений в безопасности при применении эпоэтина зета по сравнению с эпоэтином альфа. Важно, что ни у одного пациента в исследовании не развились нейтрализующие эритропоэтин-опосредованные антитела [35,36,37]. Клинические данные для эпоэтина зета при анемии, индуцированной химиотерапией, были продемонстрированы в открытом, многоцентровом международном исследовании, включившем, в общей сложности 216 пациентов, получавших химиотерапию по поводу солидных и немиелобластных опухолей [37]. В данном исследовании оценивался общий ответ на терапию и снижение риска гемотрансфузий. В общем, у 81,6% пациентов (176/216 пациентов) отмечен ответ на терапию (повышение уровня гемоглобина более чем на 10 г/л и содержание ретикулоцитов >40 000 клеток/мкл), а потребность в переливании крови была предупреждена у 175 (81,0%) пациентов. При этом средняя доза препарата за неделю составила 30 000 МЕ. В то же время, в группе эпоэтина альфа доля больных, у которых был отмечен положительный эффект на фоне антианемической терапии с повышением уровня гемоглобина в среднем на 20 г/л, составила 72,7%, а средняя доза препарата в неделю 40 000 МЕ. Лечение ЭПО хорошо переносилось, среди всех оценок ответа на переносимость терапии эпоэтином зета и альфа 605/719 (84,1%) и 602/719 (83,7%), соответственно, были оценены как превосходные за весь период наблюдения, 36 недель, исследователями и пациентами. Было отмечено стойкое повышение качества жизни (QoL) на протяжении всего периода лечения [37]. Ожидаемым осложнением при терапии ЭПО является нарушения со стороны свертывающей системы крови. В первые 12 недель лечения эпоэтином зета, у 9/216 (4,2%, 95% ДИ 1,9-7,8%) пациентов развилась клинически значимая коагулопатия. За весь период лечения, 36 недель, тромбозные нарушения развились в 11/216 (5,1%, 95% ДИ 2,6-8,9%) случаях. Ни у одного пациента не были выявлены антитела к эритропоэтинам.
Несмотря на доказанную эффективность и включение препаратов в клиническую практику, постмаркетинговый контроль за любым фармацевтическим продуктом является обязательным требованием. Фармаконадзор необходим и для биосимиляров, в соответствие с требованиями руководящих принципов ЕС по разработке биосимиляров [3]. Как правило, менеджмент побочных осложнений биосимиляров не только аналогичен, но зачастую намного жестче, по сравнению с аналогичными требованиями к эталонным продуктам. Одним из ключевых постмаркетинговых исследований эпоэтина зета стало национальное Французское постмаркетинговое обсервационное продолжительное многоцентровое исследование ORHEO, направленное на оценку эффективности и безопасности биосимиляров эпоэтина в лечении анемии в реальных клинических условиях. В исследование было включено 2333 взрослых пациентов с анемией (уровень гемоглобина менее 110 г/л) на фоне химиотерапии по поводу солидных опухолей, лимфом и миеломной болезни. Из 2333 пациентов 1839 получали химиотерапию по поводу солидных образований, 301 лимфом и 171 миеломной болезни. В исследовании участвовало 235 центров. Из 2333 пациентов, включенных в исследование, в 57,9% случаев анемия оценивалась первой степенью токсичности и варьировала в пределах 95-110 г/л. У 35,6% больных показатели крови были ниже и соответствовали второй степени токсичности (80-95 г/л). Практически всем пациентам, 99.9%, Эпоэтин зета (Retacrit TM;Hospira) вводился в средней дозе 30 000 МЕ/неделю. Только 3/2333 больных получили лечение Эпоэтином альфа (Бинокрит ®, Сандоз, Хольцкирхен, Германия). Из 2333 включенных пациентов анализ результата терапии ЭПО был проведен у 2311 больных с периодом наблюдения 3 и 6 месяцев. Через 3 месяца наблюдения 81,6% (95% ДИ 79,9183,26) пациентов ответили на лечение Эпоэтином зета независимо от вида основного заболевания. После 6 месяцев наблюдения показатель ответа на терапию ЭПО вырос до 86,5% (95% ДИ 84,80-88,10) [38].
В целом, лечение хорошо переносилось; 17,1% всех пациентов испытали по крайней мере одно клинически значимое неблагоприятное событие, которые наблюдались в единичных случаях: кровотечение (2,4%), инфекции (5,0%), реакции в месте инъекции (1,3%), тромбоэмболические нарушения (3,5%). Частота тромбоэмболических осложнений составила 2,4% и 1,5% при 3-х и 6-и месяцах наблюдения, соответственно. В ходе исследования 12% пациентам были назначены антитромботические препараты, а у 1,3% больных отмечалось повышение уровня артериального давления при 3-х и 6-и месячном наблюдении. Результаты, полученные в постмаркетинговом исследовании ORHEO, были абсолютно сопоставимы с данными III фазы клинических исследований Эпоэтина зета [36].
В настоящее время второе исследование ORHEO (NCT01626547) проводится в Германии по использованию эпоэтина зета в клинической онкологии с включением больных с анемией, индуцированной химиотерапией при лечении солидных опухолей, лимфом и миеломной болезни. В исследование вошло 300 пациентов с периодом наблюдения 6 месяцев (общая продолжительность исследования составляла 14 месяцев) [39].
В дополнение к двум упомянутым исследованиям ORHEO еще одно проспективное исследование, по оценке эффективности и безопасности эпоэтина зета у больных с миелодиспластическим синдромом низкого риска продолжается во Франции в 15 центрах (RCB 2012-A0139538).
Дополнительное исследование Эпоэтина зета также проводится у взрослых пациентов с уровнем гемоглобина ниже 110 г/л, индуцированных после аллогенной гематопоэтической трансплантация стволовых клеток [40]. Полученные в настоящее время данные постмаркетинговой безопасности эпоэтина зета согласуется с известным профилем эпоэтина альфа [37]. Не зарегистрировано ни одного случая аплазии эритроцитарного ростка костного мозга [37,39].
Заключение. Проблема коррекции анемии у онкологических пациентов, получающих химиотерапевтическое лечение в условиях онкологических отделений РК, остается нерешенной, что было продемонстрировано в ретроспективном исследовании, опубликованном ранее [5]. Международные рекомендации терапии анемий, ассоциированной с химиотерапией, указывают на необходимость терапии эпоэтинами, как в монорежиме, так и в сочетании с препаратами железа [6,7]. Представленный в данной работе опыт применения биосимиляров в странах Европы, а также краткий обзор эпоэтина зета
клинических
клинической практике на основе постмаркетинговых исследований, клиническую эффективность и доказавших его безопасность в мире, и, что является немаловажным фактом, экономическую выгоду, имел целью продемонстрировать возможности расширения доступа пациентов с цитотоксической анемией к препаратам эпоэтина в условиях Казахстана.
СПИСОК ЛИТЕРАТУРЫ
- Ludwig H., van Belle S., Barrett-Lee P. et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients // Eur. J. Cancer. 2004. Vol. 40. Р. 2293-2306.
- Groopman J.E., Itri L.M. Chemotherapy-induced anemia in adults: incidence and treatment. // J. Natl. Cancer Inst. 1999. Vol. 91. Р. 1616-1634.
- Cella D., Kallich J., McDermott A. et al. The longitudinal relationship of hemoglobin, fatigue and quality of life in anemic cancer patients: results from five randomized clinical trials. // Ann. Oncol. 2004. Vol. 15. Р. 979-986.
- Lind M., Vernon C., Cruickshank D., Wilkinson P. et al. The level of haemoglobin in anaemic cancer patients correlates positively with quality of life. // Br. J. Cancer. 2002. Vol. 86. Р. 1243-1249.
- Есентаева С.Е., Турашева Г.Б., Нуржанов А.К. и др. Результаты ретроспективного исследования по оценке рутинных подходов в лечении анемии у онкологических больных. // «Онкология и радиология Казахстана». 2018. Vol. 47., №1. С. 18-23.
- Aapro M.S., Link H. September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents. // Oncologist. 2008. Vol. 13, suppl 3. Р. 33-36.
- Rizzo J.D., Brouwers M., Hurley P. et al. American Society of Clinical Oncology/American Society of Hematology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer. // J. Clin. Oncol. 2010. Vol. 28. Р. 4996-5010.
- Glaspy J., Bukowski R., Steinberg D., Taylor C., Tchekmedyian S., Vadhan-Raj S. Impact of therapy with epoetin alfa on clinical outcomes in patients with nonmyeloid malignancies during cancer chemotherapy in community oncology practice. Procrit Study Group. // J. Clin. Oncol. 1997. Vol. 15. Р. 1218-1234.
- G.D. Demetri. Anaemia and its functional consequences in cancer patients: current challenges in management and prospects for improving therapy. // Br. J. Cancer. 2001. Vol. 84, Suppl 1. Р. 31-37.
- L. Fallowfield, D. Gagnon, M. Zagari et al. Multivariate regression analyses of data from a randomised, double-blind, placebo-controlled study confirm quality of life benefit of epoetin alfa in patients receiving non-platinum chemotherapy. // Br. J. Cancer. 2002. Vol. 87(12). Р. 1341-1353.
- D.A. Berry, N.T. Ueno, M.M. Johnson, High-Dose Chemotherapy With Autologous Stem-Cell Support As Adjuvant Therapy in Breast Cancer: Overview of 15 Randomized Trials. // J. Clin. Oncol. 2011. Vol. 29 (24). Р. 3214-3223.
- M. Auerbach, I.C. Macdougall. Safety of intravenous iron formulations: facts and folklore. // Blood Transfus. 2014. Vol. 12 (3). Р. 296-300.
- H. Ludwig, M. Aapro, C. Bokemeyer et al. A European patient record study on diagnosis and treatment of chemotherapy-induced anaemia Support Care // Cancer. 2014. Vol. 22 (8). Р. 2197-2206.
- D. H. Henry, J. Xie, T. Szczudlo, F.E. Wilhelm. Epoetin Alfa 80,000 U Every 2 Weeks vs. 40,000 U Weekly for Chemo-therapy-Induced Anemia: Colorectal Cancer Patient Subset From a Randomized Clinical Study. // Gastrointest. Cancer Res. 2008. Vol. 4 (2). Р. 205206.
- J. Bohlius, F. Valeri, M. Maskew et al. Kaposi's Sarcoma in HIV-infected patients in South Africa: multi-cohort study in the antiretroviral therapy era. // Int. J. Cancer. 2014. Vol. 135. Р. 2644-2652.
- J.T. Hartmann, O. Rick, K..Oechsle et al. Role of Postchemotherapy Surgery in the Management of Patients With Liver Metastases From Germ Cell Tumors. // Ann. Surg. 2005. Vol. 242 (2). Р. 260-266.
- Казахстанский национальный лекарственный формуляр URL: http:// http://www.knf.kz/index.php/ru/
- Biosimilars Handbook. // European Generic Medicines Association, ed 2. Brussels, European Generic Medicines Association, 2011.
- M. Weise. Biosimilars: what clinicians should know. // American Society of Hematology. 2012
- Guideline on similar biological medicinal products CHMP/437/04. Effective date:30.10.2005 URL: www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003517.pdf
- Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: quality issues URL: EMEA/CHMP/BWP/49348/2005;www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003953.pd f
- Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substances: nonclinical and clinical issues URL: EMEA/CHMP/BMWP/42832/2005;www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003920. pdf
- Revisions to overarching guidelines EMA has the following draft guidelines under public consultation to develop revised guidelines for the overarching biosimilars guidelines: Draft guideline on similar biological medicinal products Date: 22.05.2013 URL: www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/05/WC500142978.pdf
- Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (revision 1) URL: www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2012/05/WC500127960.pdf
- Guideline on similar biological medicinal products.// European Medicines Agency.-2005 URL: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003517.pdf
- Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues. // European Medicines Agency. 2013 URL: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/06/WC500144124.pdf (accessed December 2014).
- Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant erythropoietins (revision). // European Medicines Agency. 2010. URL: http://www.ema.europa.eu/docs/en_ GB/document_library/Scientific_guideline/2010/04/WC500089474.pdf
- Information guide for healthcare professionals Biosimilars in the EU. // European Medicines Agency and the European Commission. 2017, p^. 38. URL: www.ema.europa.eu/docs/en_GB/document_library/Leaflet/WC500226648.pdf
- Y. Ingrasciotta, F. Giorgianni et all. Comparative Effectiveness of Biosimilar, Reference Product and Other Erythropoiesis-Stimulating Agents (ESAs) Still Covered by Patent in Chronic Kidney Disease and Cancer Patients: An Italian Population-Based Study. // PLoS One. 2016. Vol. 11(5). Р. 169-175.
- Ebbers H.C., Muenzberg M., Schellekens H: The safety of switching between therapeutic proteins. // Expert Opin. Biol. Ther. 2012. Vol. 12. Р. 1473-1485.
- Retacrit IIN-epoetin zeta. // European Medicines Agency. 2018, p.p. 100. URL: https://www.ema.europa.eu/documents/productinformation/retacrit-epar-roduct-information_en.pdf
- FDA Briefing Document Oncologic Drugs Advisory Committee Meeting
- May 25, 2017. // FDA US Food and Drug administration. 2017. URL: https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/OncologicDrugsAdvisoryCommittee/UCM 559967.pdf
- Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники МЗ РК. URL: http://pre.dari.kz/category/search_prep
- Krivoshiev S., Todorov V.V., Manitius J. et al. Epoetin Zeta Study Group: Comparison of the therapeutic effects of epoetin zeta and epoetin alfa in the correction of renal anaemia. // Curr. Med. Res. Opin. 2008. Vol. 24. Р. 1407-1415.
- Rutkowski B, Baldamus C., Scigalla P., Koytchev R. Epoetin Zeta Study Group: Comparison of the therapeutic effects of epoetin zeta to epoetin alfa in the maintenance phase of renal anaemia treatment. // Curr. Med. Res. Opin. 2008. Vol. 24. Р. 625-637.
- Krivoshiev S., Wizemann V., Czekalski S. et al. Epoetin Zeta Study Group: Therapeutic equivalence of epoetin zeta and alfa, administered subcutaneously, for maintenance treatment of renal anemia. // Adv. Ther. 2010. Vol. 27. Р. 105-117.
- Tzekova V., Mihaylov G., Elezovic I., Koytchev R. Therapeutic effects of epoetin zeta in the treatment of chemotherapy-induced anaemia. // Curr. Med. Res. Opin. 2009. Vol. 25. Р. 1689-1697.
- Michallet M., Luporsi E., Soubeyran P. et al. ORHEO study group: Biosimilars in the management of anaemia secondary to chemotherapy in haematology and oncology: results of the ORHEO observational study. // BMC Cancer. 2014. Vol. 14. Р. 503-509.
- Michallet M., Goldet K., Sobh M. et al. Prospective study of erythropoietin use on quality of life and cost effectiveness in acute myeloid leukemia and allogeneic hematopoietic stem cell transplantation patients. // Cancer. 2013. Vol. 119. Р. 107-114.
- Niederwieser D., Schmitz S. Biosimilar agents in oncology/haematology: from approval to practice. // Eur. J. Haematol. 2011. Vol. 86. Р. 277-288.