Натуральные киллерные (NК) клетки являются важнейшими участниками противоопухолевого иммунитета. Функциональная активность NK-клеток при онкологических заболеваниях снижена, механизмы развития недостаточности NK-клеток при раке до конца не изучены. Нами было установлено, что факторы, экспрессируемые культурой клеток MiaPaCa2, обогащенной раковыми стволовыми клетками (CSC), вызывают достоверное снижение цитотоксичности NK-клеток периферической крови здоровых доноров.
Введение.
Онкологические заболевания устойчиво держат второе место среди основных причин смертности во всем мире [1]. Использование NK-клеток в иммунотерапии онкологических заболеваний считается перспективным, так как их успешное применение обеспечило бы высокоспецифическое лечение злокачественных новообразований, не имеющее побочных эффектов. NK-клетки представляют собой гранулярные лимфоциты, относящиеся к системе врожденного иммунитета. Мишенями NK-клеток являются вирус- инфицированные и опухолевые клетки организма, которые частично или полностью утратили экспрессию молекул MHC I класса и экспрессируют поверхностные молекулы, индуцируемые клеточным стрессом. Таким образом, NK-клетки являются эффекторами первой линии защиты против малигнизированных опухолевых клеток.
Для многих типов опухолей характерным является наличие двух компартментов клеток: дифференцированных раковых клеток с быстрым симметричным делением и раковых стволовых клеток (CSC), характеризующихся асимметричным типом деления. Было показано, что именно CSC могут давать начало большинству опухолей. Более того, эти клетки оказались резистентными к традиционной химиотерапии и способными к формированию новых очагов опухоли через метастазирование [2].
Многочисленные исследования выявили значительное снижение количества NK-клеток в периферической крови и опухолевой ткани, а также их противоопухолевой активности при различных типах рака [3]. Так, было показано, что среди NK- клеток больных меланомой было отмечено увеличение доли CD56brightCD16+-клеток со сниженной цитолитической активностью, и снижение доли цитотоксических CD56dimCD16+ NK- клеток, которые обладали пониженным уровнем цитотоксичности и продукции IFN-γ. Кроме того, у NK-клеток больных острой миелоидной лейкемией и раком молочной железы, поджелудочной железы, желудка и колоректальным раком был обнаружен пониженный уровень экспрессии активирующих рецепторов CD161, NKG2D, CD16, NKp30, NKp46, сопровождающийся снижением продукции перфорина и суперэкспрессией ингибирующего рецептора CD158a, что коррелировало со снижением их цитотоксичности [4,5]. Молекулярные и клеточные механизмы недостаточности
функциональной активности NK-клеток при онкологических заболеваниях остаются до конца неизученными. Между тем, появилось представление об индукции «расщепленной анергии» (“split anergy”) NK-клеток, возникающей после контакта с опухолевыми клетками, в том числе и CSC [6]. Так, серией работ A.Jewett и соавт. [7-9] было показано, что NK-клетки обладают естественной способностью уничтожать стволовые клетки, в том числе и CSC, после чего теряют способность к лизису NK- чувствительных клеток-мишеней, включая клетки эритролейкемии К562, оральные сквамозные карциномные клетки, мезенхимальные стволовые клетки, стволовые клетки зубной пульпы, эмбриональные стволовые клетки и индуцированные плюрипотентные стволовые клетки после физического контакта с ними. При этом снижение цитолитической активности NK-клеток сопровождается индукцией продукции IFN-γ, снижением секреции IL-6 и изменением фенотипа CD16+CD56+/dimCD69- на CD16-CD56dim/-CD69+. В качестве основных причин изменения функциональной активности NK-клеток рассматривается влияние иммуносупрессорного микроокружения опухоли и растворимых и/или мембран-ассоциированных факторов, экспрессируемых опухолевыми клетками.
Целью исследования явилось изучение влияния растворимых факторов, секретируемых различными опухолевыми линиями и прямого межклеточного контакта панкреатических опухолевых клеток, в том числе обогащенных CSC на цитолитическую активность NK-клеток человека в условиях культивирования.
Материалы и методы.
В ходе исследования использовали венозную кровь здоровых доноров, стабилизированную ЭДТА (2 мг/мл). Мононуклеарные клетки выделяли центрифугированием на одноступенчатом градиенте плотности перкола (Sigma-Aldrich, США) с плавучей плотностью 1,077 г/мл и отмывали средой RPMI-1640 (Sigma-Aldrich, США). Выделение NK-клеток проводили с помощью набора «NK Cell Isolation Kit, human» (Miltenyi Biotech, Германия) согласно прописи фирмы-производителя, используя колонки типа CS+ и магнитный сепаратор VarioMACS (Miltenyi Biotech, Германия). Чистоту полученной популяции клеток оценивали с помощью проточной цитофлуориметрии в гейте CD3-CD56+ , которая составляла не менее 98¿.
В работе были использованы клеточные линии эритролейкемии K562, гепатоцеллюлярной карциномы HepG2 и рака поджелудочной железы MiaPaCa2, полученные из ATCC (American Type Culture Collection, USA). Для изучения влияния CSC использовали клетки родительской линии MiaPaCa2 (Par), в том числе после их стимуляции рекомбинантными человеческими цитокинами (Par- TT) TGF-β и TNF-α (Sigma-Aldrich, США), а также супернатанты культуры туморосфер, полученных из клеток данной клеточной линии (TS и TS-TT, соответственно).
Во всех экспериментах клетки культивировали в концентрации, не превышающей 2Ä106 кл./мл, в полной культуральной среде (ПКС), содержащей 10¿ фетальной бычьей сыворотки (FBS), 2 мМ глутамина, 100 МЕ/мл пенициллина и 100 мг/мл стрептомицина (Sigma-Aldrich, США) при 37оС и 5¿ СО2 в СО2- инкубаторе. Опухолевые клетки культивировали в ПКС на основе RPMI-1640 (K562) или DMEM (HepG2, MiaPaCa2). Для получения TS из клеток Par, клетки культивировали в специальной среде (SCM), основанной на среде DMEM-F12, содержащей 20 нг/мл рекомбинантного эпидермального ростового фактора (EGF), 20 нг/мл рекомбинантного основного ростового фактора фибробластов (bFGF) (Sigma- Aldrich, США), две витаминные добавки N2 и B27 без витамина А (Life Technology, США) в однократной концентрации, 3¿ FBS и 15 мМ HEPES для стабилизации рН. Клетки переносили в неадгизирующую культуральную посуду, в частности, в специальные планшеты типа ultra-low-attachment или обычные планшеты, покрытые 2¿ раствором poly-HEMA (Sigma-Aldrich, США), блокирующим клеточную адгезию, в концентрации 104-2х104 кл./мл и инкубировали в СО2-инкубаторе в отсутствии СО2 в атмосфере в течение 7-10 дней, добавляя через каждые 2 дня по 150-200 мкл свежей среды. Первые туморосферы появлялись через 2-3 дня.
Для изучения влияния растворимых факторов, секретируемых опухолевыми клетками, на активность NK-клеток, мононуклеарные клетки здоровых доноров инкубировали в супернатантах культур опухолевых клеток с добавлением 10¿ FBS в течение 18 ч. Для получения супернатантов клетки K562, HepG2, Par, TS и TS-TT культивировали в ПКС в течение 3 суток, затем суспензию клеток центрифугировали и собирали надосадочную жидкость. В качестве контролей для супернатантов опухолевых клеток Par, Par-TT и HepG2 мононуклеарные клетки инкубировали в ПКС на основе DMEM, для K562 - RPMI-1640, а для TS и TS-TT – SCM, соответственно.
Влияние прямого клеточного контакта Par и Par-TT на NK-клетки изучали ко-культивируя их в ячейках 96-луночного планшета в концентрации 2х103кл./лун. с монослоем адгезированных клеток Par и Par-TT в течение 18 ч.
Цитотоксичность NK-клеток определяли в стандартном цитотоксическом тесте против K562, меченных витальным красителем CFSE (Sigma- Aldrich, США), инкубируя клетки в соотношении эффектор:мишень 10:1 - для NK-клеток и 30:1 - для мононуклеаров, в 96-луночных круглодонных планшетах в ПКС в течение 4 ч. После этого к клеткам добавляли флуоресцентный краситель PI для окрашивания мертвых клеток, инкубировали в темноте при комнатной температуре в течение 10 мин и анализировали с помощью проточной цитофлуориметрии процент клеток, позитивных по CFSE и PI на проточном цитометре FΑCS Calibur (BD Biosciences, США) с использованием программы CellQuest (BD Biosciences).
Результаты и обсуждение.
При изучении влияния растворимых факторов клеточных линий K562 и HepG2 на цитотоксичность NK-клеток мы не естатистически значимой разницы по сравнению с контролем нами не было обнаружено (данные не показаны).
Следующим нашим шагом было сравнение влияния растворимых факторов, секретируемых дифференцированными опухолевыми клетками или культурой опухолевых клеток, обогащенных CSC. Ранее в нашей лаборатории была отработана технология получения культур опухолевых клеток MiaPaCa2, обогащенных CSC, путем стимуляции Par цитокинами TGF-β и TNF-α и индукцией образования туморосфер. При этом было установлено, что стимуляция TNF-α и TGF-β повышала в 2,5 раза долю клеток, экспрессирующих маркеры CSC (CD133+CD44v6+) - в культурах Par-TT и TS-ТТ по отношению к исходным родительским клеткам (не опубликованные данные). Таким образом, для сравнения влияния факторов, секретируемых клетками родительской линии дифференцированных опухолевых клеток и культурой, обогащенной CSC, в настоящем исследовании были использованы культуры клеток Par, Par-TT, TS и TS-ТТ, соответственно.
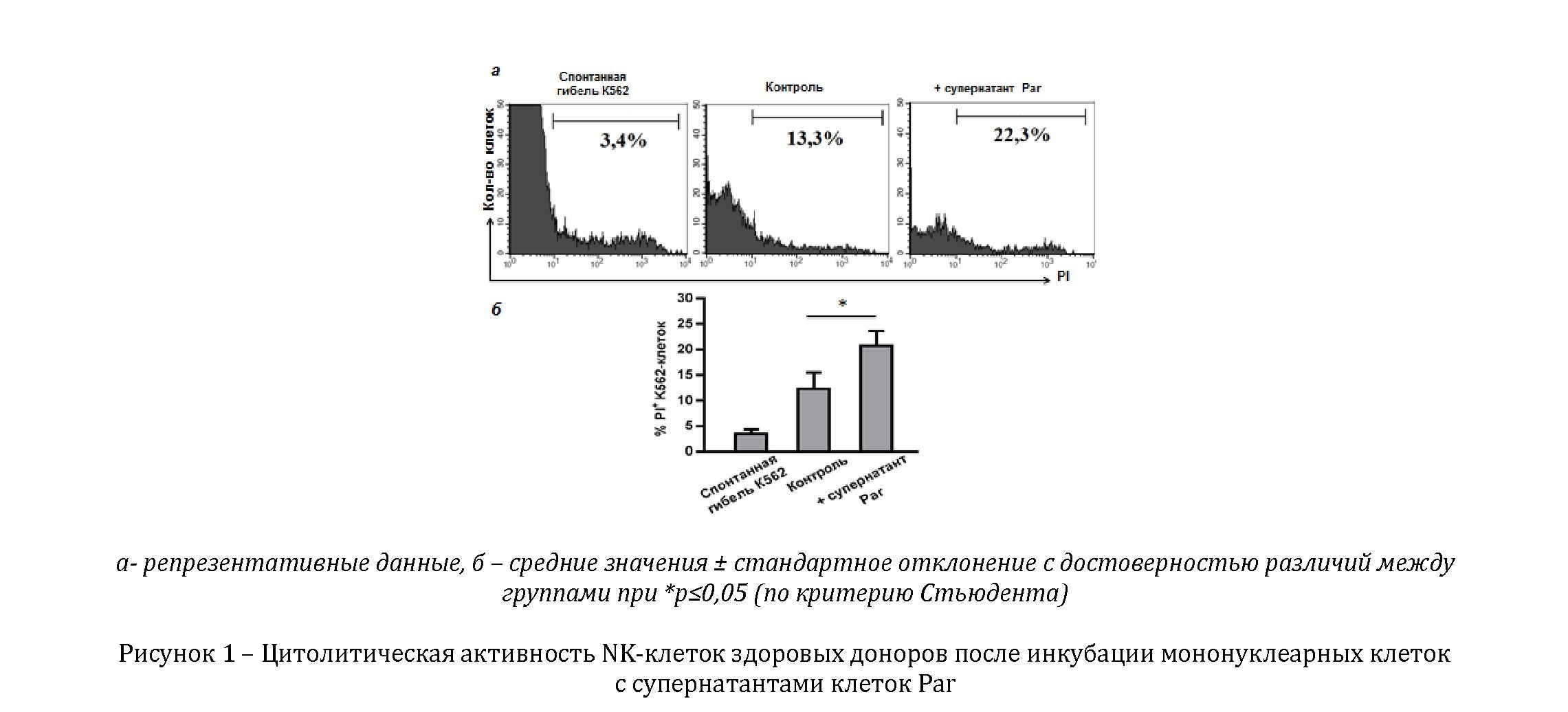
В ходе исследования нами было обнаружено достоверное повышение цитолитической активности NK-клеток после воздействия супернатантов Par (рисунок 1). Данный эффект может быть связан с секрецией клетками культуры MiaPaCa2 IL-8 и протеин-1-хемо-аттрактанта моноцитов (MCP-1), как было ранее показано, повышающих цитолитическую активность NK-клеток [10].
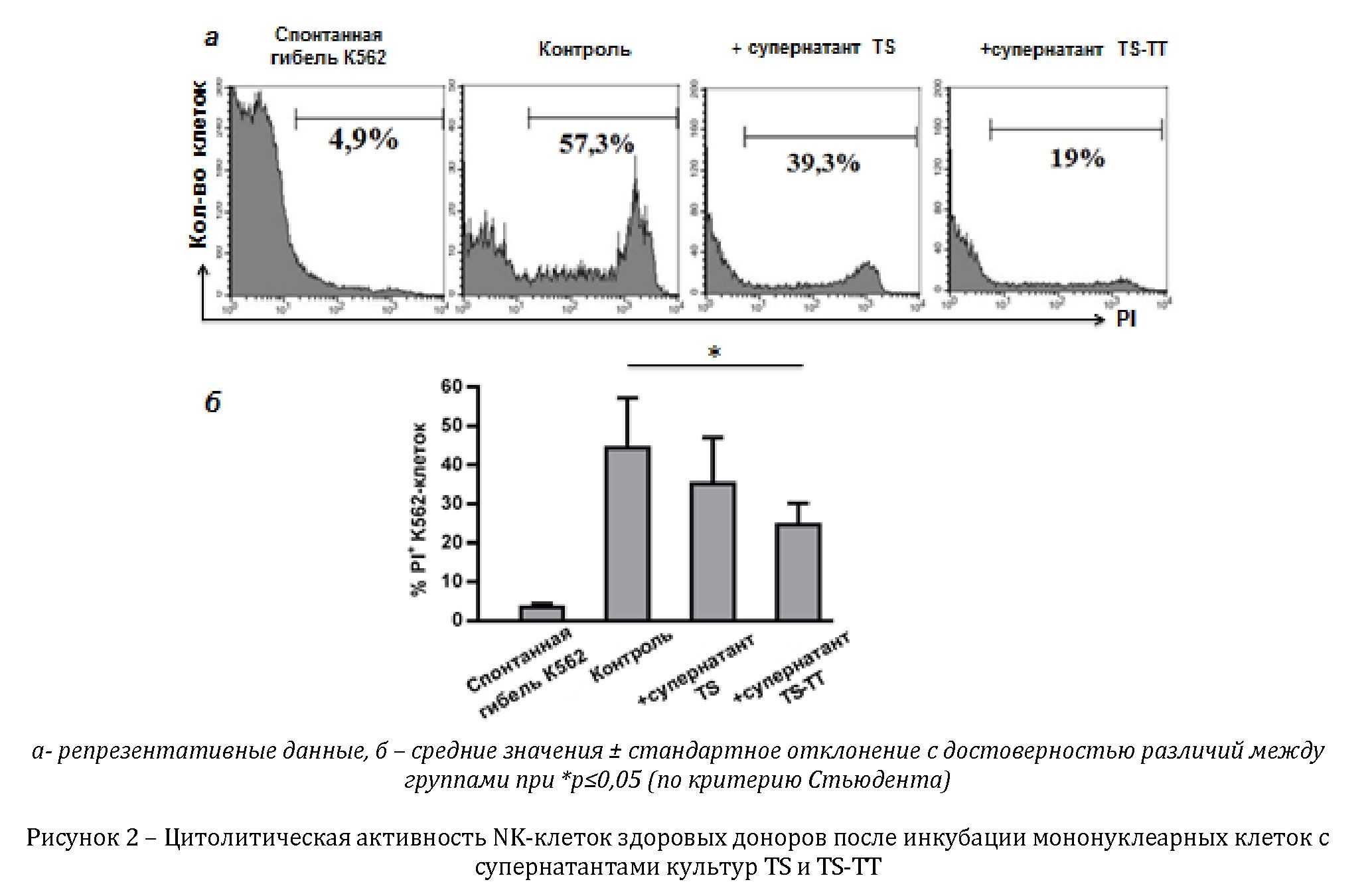
В экспериментах по изучению влияния растворимых факторов, секретируемых TS, нами не было обнаружено изменений цитолитической активности NK-клеток, при этом супернатанты культур TS-TT достоверно снижали данный показатель в среднем на 20¿ по сравнению с контролем (рисунок 2).
В связи с этим мы можем сделать вывод о том, что растворимые факторы культур опухолевых клеток, обогащенных CSC, в отличие от факторов, секретируемых более дифференцированными опухолевыми клетками, оказывают супрессорный эффект на функциональную активность NK-клеток.
Следующим нашим шагом было изучение влияния непосредственного контакта опухолевых клеток линии MiaPaCa2 c NK-клетками, на их функциональную активность. Проведенные эксперименты показали достоверное снижение цитотоксичности NK-клеток после их прямого контакта как с клетками Par, так и Par-TT (рисунок 3).
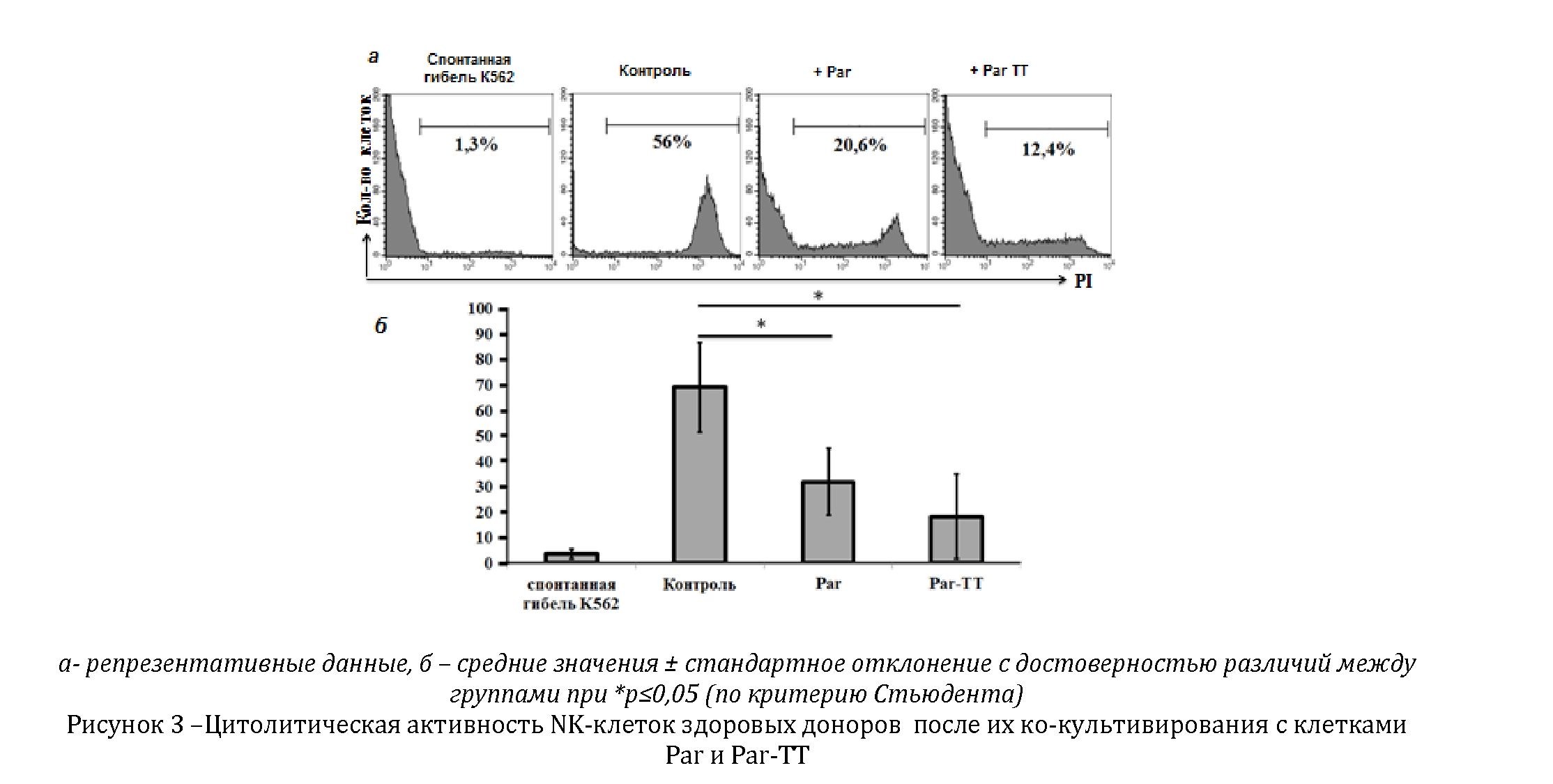
Отсутствие различий между группами Par и Par-TT возможно связано с тем, что обе популяции, как дифференцированные опухолевые клетки, так и CSC, несут на своих мембранах супрессорные молекулы, способствующие приобретению NK-клетками состояния анергии. Другое объяснение может быть связано с низким содержанием CSC в обеих культурах (от 1 до 3¿), которого, однако, вполне хватает для того, чтобы индуцировать функциональную анергию у NK-клеток.
Заключение.
В результате проведенных экспериментов мы установили, что растворимые факторы, секретируемые дифференцированными опухолевыми клетками линий HepG2, K562 и MiaPaCa2, не изменяют цитолитической активности NK-клеток. Однако супернатанты культур клеток линии MiaPaCa2, обогащенных CSC, полученных методом культуры туморосфер или стимуляцией TGF-ß и TNF- α, существенно снижают цитотоксичность NK-клеток. Очевидно, это связано с продукцией супрессорных факторов именно клетками фракции CSC. Прямой контакт клеток этой линии вызывает подавление цитотоксичности NK-клеток, возможно, посредством мембран-ассоциированных молекул с супрессорным действием. Является ли этот феномен результатом действия CSC или дифференцированных опухолевых клеток остается не ясным.
Полученные нами данные позволяют предположить, что попадая в опухолевую ткань, NK-клетки становятся анергичными под воздействием факторов, экспрессируемых опухолевыми клетками, секретируемых в виде растворимых молекул, либо ассоциированных с клеточной мембраной, что может быть причиной общего снижения потенциала противоопухолевого иммунитета и прогрессивного роста опухоли. Полученные результаты могут послужить основой дальнейшего изучения молекулярных механизмов снижения противоопухолевой активности NK-клеток при онкологических заболеваниях и поиска наиболее эффективных мишеней для комбинированной коррекции данного процесса.
СПИСОК ЛИТЕРАТУРЫ
- Stewart B.W., Wild C.P. World Cancer Report // J. IARC Nonserial Pub. - 2014. - №2. - P. 630-637.
- Tang C., Ang B.T., Pervaiz S. Cancer stem cell: target for anti-cancer therapy // J. Faseb. – 2007. - Vol. 21. – P. 3777–3785.
- Levy E.M., Roberti M.P., Mordoh J. Natural killer cells in human cancer: from biological functions to clinical applications // J. Biomed. Biotechnol. – 2011. Р. 676-682.
- Caras I., Grigorescu A., Stavaru C., Radu D.L., Mogos I., Szegli G., Salageanu A. Evidence for immune defects in breast and lung cancer patients // Cancer Immunol. – 2004. – Vol. 53. – P. 1146–1152.
- Peng Y.P., Zhu Y., Zhang J.J., Xu Z.K., Qian Z.Y., Dai C.C., Jiang K.R., Wu J.L., Gao W.T., Li Q., Du Q., Miao Y. Comprehensive analysis of the percentage of surface receptors and cytotoxic granules positive natural killer cells in patients with pancreatic cancer, gastric cancer, and colorectal cancer // J. Trans. Med. – 2013. – Vol. 11. – P. 262-270.
- Belyaev N.N., Abramova V.A. Transmission of "split anergy" from tumor infiltrating to peripheral NK cells in a manner similar to "infectious tolerance" // J. Med. Hypotheses. – 2014. – Vol. 82. – P. 129-133.
- Jewett A., Bonavida B. Target-induced anergy of natural killer cytotoxic function is restricted to the NK-target conjugate subset // J. Cell. Immunol. – 1995. – Vol. 160. – P. 91–97.
- Jewett A., Tseng H-Ch. Potential rescue, survival and differentiation of cancer stem cells and primary non-transformed stem cells by monocyte-induced split anergy in natural killer cells // J.Cancer Immunol. Immunother. – 2012. – Vol. 61. - P. 265–274.
- Tseng H-C., Cacalano N., Jewett A. Split anergized natural killer cells halt inflammation by inducing stem cell differentiation, resistance to NK cell cytotoxicity and prevention of cytokine and chemokine secretion // J. Oncotarget. – 2015. – Vol. 6. - № 11. –P. 8947–8959.
- Lewis J.A., Dennis W.E., Hadix J., Jackson D.A. Analysis of secreted proteins as an in vitro model for discovery of liver toxicity markers // J. Proteome Res. – 2010. – Vol. 9. – P. 5794–5802.