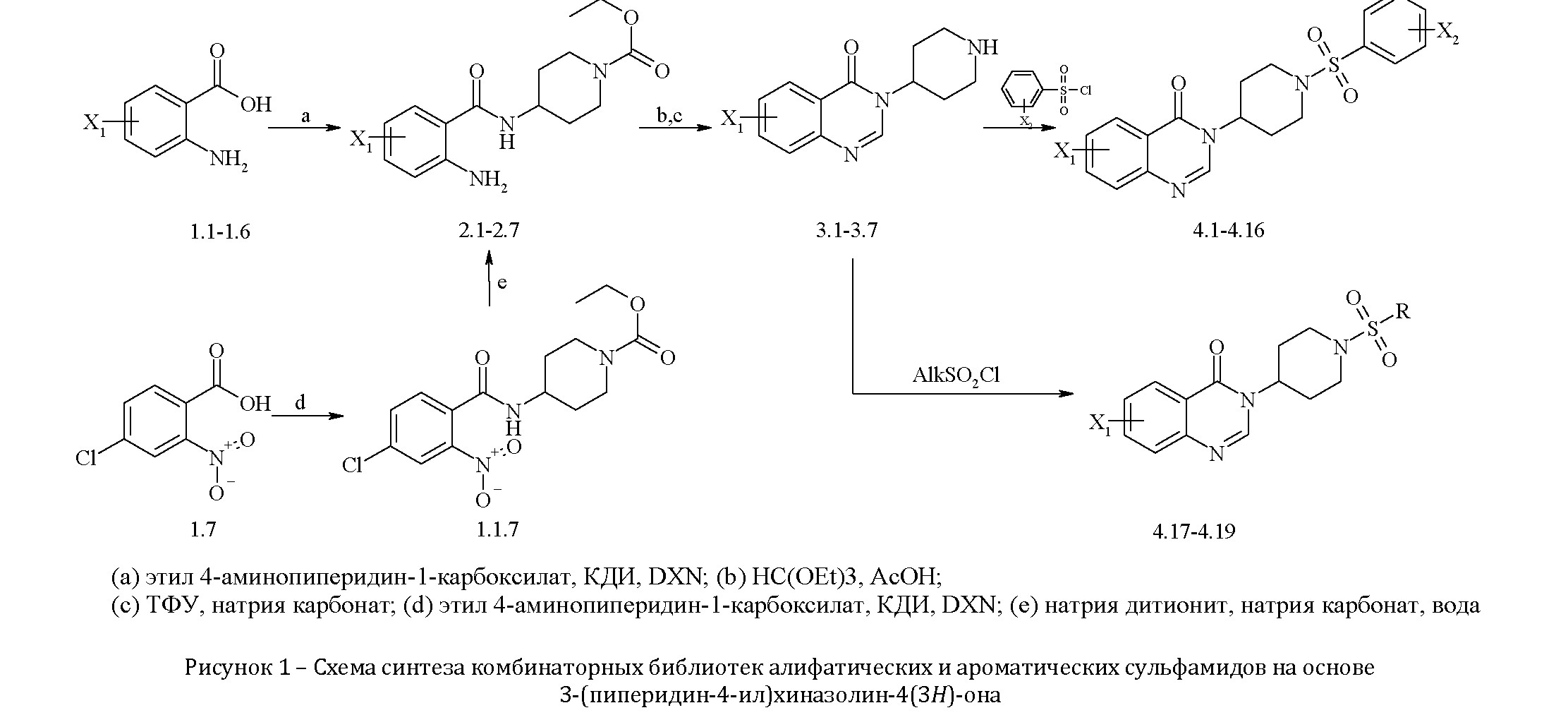
Разработаны методики, позволяющие получать алифатические и ароматические сульфамиды на основе 3-(пиперидин-4- ил)хиназолин-4(3Н)-онового скаффолда методами параллельного жидкофазного синтеза. Проведены исследования по определению биологической активности полученных образцов. Предложенные схемы синтеза позволяют получать комбинаторные библиотеки биологически активных 3-[1-(арил(алкил)сульфонил)пиперидин-4-ил]хиназолин-4(3H)-онов, имеющие различные заместители в хиназолиновом ядре.
Синтез новых физиологически активных веществ играет большую роль в разработке лекарственных препаратов. Как показывает обзор литературы, в этом плане очень перспективными являются производные хиназолина, модифицированные в положении 3 пиперидиновым циклом. Было установлено, что данные соединения могут использоваться при лечении болезни Альцгеймера благодаря своему взаимодействию с М1 мускариновыми рецепторами [1], также доказана перспективность их использования в борьбе с ВИЧ [2]. Среди прочих видов фармакологической активности можно выделить антиатеросклеротическую [3], антигипертензивную [4], антиастматическую [5] и противовирусную [6], присущие данным соединениям. Взаимодействие хиназолонов модифицированных пиперидином с серотониновыми 5-НТ3 рецепторами дает возможность использовать эти соединения для разработки разнообразных групп лекарственных средств [7]. Блокаторы данной группы рецепторов хорошо известны как противорвотные препараты с цитотоксической активностью, что расширяет спектр их применения не только как антиеметиков, но и цитотоксических препаратов в химиотерапии онкологических заболеваний. Благодаря регуляции работы натриевых каналов структурные аналоги производных 3- (пиперидин-4-ил)хиназолин-4(3Н)-она применяются при состояниях, сопровождающихся болью [8]. Доказано, что под действием соединений данного класса происходит аутофагия клеток [9], также имеются данные о возможности их использования в качестве активаторов глюкокиназы [10]. Учитывая весьма широкий спектр физиологической активности данных соединений, интересным с точки зрения поиска новых лекарственных препаратов является синтез рядов сульфаниламидов на основе 3-(пиперидин-4- ил)хиназолин-4(3Н)-она и исследование их биологической активности. Разнообразие этих соединений создает большее пространство для проведения фармакологических исследований.
Материалы и методы исследования. Все растворители и реагенты были получены их коммерческих источников. Температуры плавления (°С) определяли при помощи прибора Кофлера. 1Н ЯМР-спектры записывали при 200 МГц на спектрометре Varian Mercury-200, в качестве внутреннего стандарта использовали ТМС. Химические сдвиги приведены в шкале δ (м. д.).
Общая методика получения этил 4-[(2- аминобензоил)амино]пиперидин-1-карбоксилатов (2.1-2.6).
К 0,1 моль соответствующей замещенной 2-аминобензойной кислоты (1.1-1.6) в 100 мл абсолютного 1,4-диоксана (DXN) добавляли порциями 0,108 моль (17,51 г) 1,1'- карбонилдиимидазола (КДИ) и смесь перемешивали при нагревании 70-80°С до растворения и потом еще 15 минут. К полученному таким образом раствору имидазолида прибавляли 0,1 моль (17,23 г) этил 4-аминопиперидин-1- карбоксилата и смесь перемешивали при нагревании 40- 50°С в течении 5-7 часов. После охлаждения реакционную смесь разводили водой и осадок соединений (2.1-2.6) отфильтровывали. Выходы полученных соединений 75-80%. Этил 4-[(2-нитро-4-хлорбензоил)амино]пиперидин-1- карбокислат (1.1.7).
К 0,05 моль (10 г) 2-нитро-4-хлорбенозойной кислоты 1.7 в среде абсолютного 1,4-диоксана добавляли 0,055 моль (8,92 г) КДИ и смесь перемешивали при нагревании 15 минут. Далее к раствору имидазолида прибавляли 0,05 моль (8,62 г) этил 4-аминопиперидин-1-карбоксилата и смесь перемешивали при нагревании 40-50°С в течении 5-7 часов. Выход реакции составил 88%.
Этил 4-[(2-амино-4-хлорбензоил)амино]пиперидин-1- карбоксилат (2.7).
К 0,04 моль (14,23 г) этил 4-[(2-нитро-4- хлорбензоил)амино]пиперидин-1-карбокислата 1.1.7 добавляли 0,14 моль (24,38 г) дитионита натрия и 0,14 моль (14,84 г) карбоната натрия в 250 мл воды перемешивали при 40°С в течение 48 часов. Осадок соединения 2.7, который образовался, отфильтровывали и промывали водой. Выход 57%.
Общая методика синтеза 3-(пиперидин-4-ил)хиназолин- 4(3Н)-онов (3.1-3.7).
Смесь соединения 2 (0,05 моль) и триэтилортоформиата (0,075 моль) в 46 мл ледяной уксусной кислоты кипятили на протяжении 5-8 часов. Далее к охлажденному раствору добавляли воду и перемешивали до образования твердого осадка продукта 3. Осадок отфильтровывали и промывали на фильтре водой. Выходы 67-84%.
К выделенному продукту добавляли 6-ти кратный по массе избыток 30% водной трифторуксусной кислоты (ТФУ), и смесь кипятили с обратным холодильником 3-4 часа до прохождения реакции гидролиза. После охлаждения смесь нейтрализовывали 40% раствором натрия карбоната и экстрагировали этилацетатом. После, органический слой отделяли, высушивали безводным сульфатом магния и удаляли растворитель при пониженном давлении. Выходы 60-83%.
Общая методика получения 3-[1- (арил(алкил)сульфонил)пиперидин-4-ил]хиназолин-4(3H)- онов (4.1-4.19).
К раствору амина 3 (0,001 моль) в 2,5 мл диметилформамида добавляли 0,0011 моль (0,11 г) триэтиламина и 0,001 моль соответствующего сульфохлорида. Смесь перемешивали при 50°С в течение 3 часов. Далее реакционную смесь разводили водой, а осадок отфильтровывали и перекристаллизовывали из 2-пропанола. Выходы продуктов составили 70-75%.
При проведении исследований противомикробной активности in vitro в соответствии с рекомендациями ВОЗ
[11,12] использовали тест-штаммы грамположительных (Staphylococcus aureus ATCC 25923, Bacillus subtilis ATCC 6633), грамотрицательных (Esherichia coli ATCC 25922, Proteus vulgaris ATCC 4636, Pseudomonas aeruginosa ATCC 27853) бактерий и грибов (Candida albicans ATCC653/885). Микробная нагрузка составляла 107 микробных клеток на 1 мл среды и устанавливалась по стандарту McFarland. В работу бралась 18-24 часовая культура микроорганизмов. Для исследований использовали агар Мюллера-Хинтона (Дагестанский НИИ питательных сред). Соединения вводили методом диффузии в агар («колодцами») в виде раствора в диметилсульфоксиде (ДМСО) в концентрации 100 мкг/мл в объеме 0,3 мл.
Результаты и обсуждения. Для синтеза промежуточных этил 4-[(2-аминобензоил)амино]пиперидин-1- карбоксилатов (2.1-2.7), которые использовали как полупродукты при получении 3-(пиперидин-4- ил)хиназолин-4(3Н)-онового цикла использовалось несколько подходов. Один из них, описанный раннее в литературе [2,3,7], заключается во взаимодействии галоген- и алкилзамещенных 2-аминобензойных кислот (1.1-1.6) с амином, в данном случае с этил 4-аминопиперидин-1- карбоксилатом в присутствии конденсирующего реагента. Согласно второго синтетического подхода во избежание аномальной растворимости и трудностей выделения амида 2.7, в качестве исходного соединения была взята 2-нитро-4- хлорбензойная кислота (1.7). При восстановлении
нитрогруппы промежуточного этил 4-[(2-нитро-4- хлорбензоил)амино]пиперидин-1-карбокислата (1.1.7) натрия дитионитом в водной среде легко выделялся целевой аминоамид (2.7). В обоих случаях N-карбэтокси защищенная аминогруппа пиперидинового цикла обеспечивает селективность прохождения реакции амидирования.
При интенсивном нагреве замещенных этил 4-(2- аминобензамидо)пиперидин-1-карбоксилатов (2.1-2.7) в среде уксусной кислоты и присутствии муравьиного ортоэфира они образовывали продукты гетероциклизации – замещенные 3-(пиперидин-4-ил)хиназолин-4(3Н)-ононы. Защитная N-карбэтокси группа уретанового типа снималась при нагреве в среде ТФУ. Соответствующая аммонийная соль переводилась в основное состояние добавлением 40%- го раствора натрия карбоната, из которого целевые соединения (3.1-3.7) экстрагировались этилацетатом. Заместители и физико-химические данные синтезированных полупродуктов приведены в таблице 1.
Полученные вторичные амины были исследованы на реакционную способность в реакции образования сульфамидов. В качестве сульфамидирующих агентов были выбраны хлорангидриды ароматических и алифатических сульфокислот, что позволило получить представителей как 3-[1-(арилсульфонил)пиперидин-4-ил]хиназолин-4(3H)- онов (4.1-4.16), так и 3-[1-(алкилсульфонил)пиперидин-4- ил]хиназолин-4(3H)-онов (4.17-4.19).
Данные о заместителях и физико-химических свойствах представлена на рисунке 1, данные 1Н ЯМР-спектроскопии рядов соединений приведены в таблицах 2 и 3 полученных соединений представлены в таблице 4.
соответственно. Схема синтетических превращений
Таблица 1 – Физико-химические данные и результаты прогноза биологической активности замещенных 3-(пиперидин-4- ил)хиназолин-4(3⅜)-онов (3.1-3.7)
|
№ з/п |
X1 |
tпл., °C |
М.м. |
Брутто формула |
PASS |
|
|
Nootropic |
Analg. non-op. |
|||||
|
3.1 |
8-Me |
207-209 |
243,30 |
C14H17N3O |
0,679 |
0,443 |
|
3.2 |
8-Cl |
200-202 |
263,72 |
C13H14ClN3O |
0,546 |
0,524 |
|
3.3 |
6-Cl |
171-173 |
263,72 |
C13H14ClN3O |
0,653 |
0,501 |
|
3.4 |
7-F |
226-228 |
247,27 |
C13H14FN3O |
0,775 |
0,550 |
|
3.5 |
6-F |
141-143 |
247,27 |
C13H14FN3O |
0,780 |
0,547 |
|
3.6 |
6-Me |
143-145 |
243,30 |
C14H17N3O |
0,701 |
0,420 |
|
3.7 |
7-Cl |
255-257 |
263,72 |
C13H14ClN3O |
0,645 |
0,502 |
237
Таблица 2 - Физико-химические данные и результаты прогноза биологической активности 3-[1-(арилсульфонил)пиперидин-4- ил]хиназолин-4(3H)-онов (4.1-4.16)
|
№ п/п |
X1 |
X2 |
tпл., °C |
М.м. |
Брутто формула |
PASS |
|
|
Nootropic |
Analg. non-op. |
||||||
|
4.1 |
7-Cl |
2,4-diF |
234-236 |
439,86 |
C19H16ClF2N3O3S |
0,566 |
0,653 |
|
4.2 |
7-F |
4-í'Pr |
216-218 |
429,51 |
C22H24FN3O3S |
0,832 |
0,561 |
|
4.3 |
7-F |
2-Me |
185-187 |
401,45 |
C20H20FN3O3S |
0,628 |
0,740 |
|
4.4 |
7-F |
4-CO2Et |
212-214 |
459,49 |
C22H22FN3O5S |
0,779 |
0,541 |
|
4.5 |
7-F |
3,5-diF |
246-248 |
423,41 |
C19H16F3N3O3S |
0,769 |
0,600 |
|
4.6 |
7-F |
2,5-diOMe |
193-195 |
447,48 |
C21H22FN3O5S |
0,775 |
0,443 |
|
4.7 |
7-F |
4-Me |
223-225 |
401,45 |
C20H20FN3O3S |
0,762 |
0,599 |
|
4.8 |
7-F |
2,4-diMe |
202-204 |
415,48 |
C21H22FN3O3S |
0,621 |
0,738 |
|
4.9 |
6-F |
4-OMe |
237-239 |
417,45 |
C20H20FN3O4S |
0,778 |
0,528 |
|
4.10 |
6-F |
4-Me |
265-267 |
401,45 |
C20H20FN3O3S |
0,768 |
0,598 |
|
4.11 |
6-F |
2,5-diOMe |
216-218 |
447,48 |
C21H22FN3O5S |
0,780 |
0,441 |
|
4.12 |
6-F |
4-í'Pr |
269-271 |
429,51 |
C22H24FN3O3S |
0,837 |
0,559 |
|
4.13 |
6-F |
3-Cl, 4-Me |
258-260 |
435,90 |
C20H19ClFN3O3S |
0,564 |
0,643 |
|
4.14 |
6-F |
3,5-diMe |
262-264 |
415,48 |
C21H22FN3O3S |
0,763 |
0,622 |
|
4.15 |
6-F |
3-CF3 |
197-199 |
455,43 |
C20H17F4N3O3S |
0,791 |
0,673 |
|
4.16 |
6-Cl |
3-F,4-Me |
260-262 |
435,90 |
C20H19ClFN3O3S |
0,453 |
0,594 |
Таблица 3 - Физико-химические данные и результаты прогноза биологической активности 3-[1-(алкилсульфонил)пиперидин-4- ил]хиназолин-4(3Я)-онов (4.17-4.19)
|
№ п/п |
X1 |
R |
tпл., °C |
М.м. |
Брутто формула |
PASS |
|
|
Nootropic |
Analg. non-op. |
||||||
|
4.17 |
6-Cl |
Et |
242-244 |
355.08 |
C1sH18¤N3O3S |
0,666 |
0,427 |
|
4.18 |
7-F |
Me |
254-256 |
325,09 |
C14H16FN3O3S |
0,675 |
0,581 |
|
4.19 |
7-F |
Et |
225-227 |
339,11 |
C15H18FN3O3S |
0,783 |
0,470 |
Таблица 4 - Данные 1H ЯМР-спектроскопии синтезированных соединений 3.1-3.7 и 4.1-4.19.
|
№ п/п |
Химический сдвиг, δ, м.д. |
|
|
ArH |
AlkH |
|
|
3.1 |
8,46 (1H, с., 2H); 7,98 (1H, д., 5H); 7,68 (1H, д., 6H); 7,38 (1H, т., 7H). |
1,70-2,02 (4H, м., N(CH2СH2)2CH); 2,52 (3H, с., 8CH3); 2,70-3,08+4,10 (4H, м+т., N(CH2СH2)2CH); 4,70-4,90 (1H, м., N(CH2СH2)2CH). |
|
3.2 |
8,57 (1H, с., 2H); 8,11 (1H, с., 5H); 7,95 (1H, д., 6H); 7,48 (1H, т., 7H). |
1,71-2,01 (4H, м., N(CH2СH2)2CH); 2,70-3,08+4,12 (4H, м.+т., N(CH2СH2)2CH); 4,70-4,90 (1H, м., N(CH2СH2)2CH). |
|
3.3 |
8,45 (1H, с., 2H); 8,07 (1H, с., 5H); 7,85 (1H, д., 7H); 7,71 (1H, д., 8H). |
1,60-1,98 (4H, м., N(CH2СH2)2CH); 2,60+4,01 (4H, т.+д., N(CH2СH2)2CH); 4,55-4,70 (1H, м., N(CH2СH2)2CH). |
|
3.4 |
8,50 (1H, с., 2H); 8,18 (1H, т., 5H); 7,31-7-50 (2H, м., 6H+8H). |
1,72-2,10 (4H, м., N(CH2СH2)2CH); 2,70+4,08 (4H, м.+д., N(CH2СH2)2CH); 4,70-4,90 (1H, м., N(CH2СH2)2CH). |
|
3.5 |
8,45 (1H, с., 2H); 7,60-7,82 (3H, м., 5H+7H+8H). |
1,71-2,10 (4H, м., N(CH2СH2)2CH); 2,68-3,08+4,17 (4H, м.+д., N(CH2СH2)2CH); 4,70-4,90 (1H, м., N(CH2СH2)2CH). |
|
3.6 |
8,38 (1H, с., 2H); 7,92 (1H, с., 5H); 7,82 (1H, д., 7H); 7,78 (1H, д., 8H). |
1,61-1,98 (4H, м., N(CH2СH2)2CH); 2,45 (3H, с., 6CH3); 2,50-2,70+3,01 (4H, м.+д., N(CH2СH2)2CH); 4,60-4,78 (1H, м., N(CH2СH2)2CH). |
|
3.7 |
8,45 (1H, с., 2H); 8,12 (1H, д., 5H); 7,61 (1H, с., 8H); 7,55 (1H, д., 6H). |
1,68-2,08 (4H, м., N(CH2СH2)2CH); 2,62+3,05 (4H, т.+д., N(CH2СH2)2CH); 4,58-4,75 (1H, м., N(CH2СH2)2CH). |
|
4.1 |
8,45 (1H, с., 2H); 8,13 (1H, д., 5H); 7,87 (1H, кв., 6H); 7,65 (1H, д., 8H); 7,46-7,54 (2H, м., 5´H+6´H); 7,28 (1H, с., 3´H). |
1,90+2,18 (4H, д.+кв., N(CH2СH2)2CH); 2,74+3,90 (4H, т.+д., N(CH2СH2)2CH); 4,66 (1H, т., N(CH2СH2)2CH). |
|
4.2 |
8,43 (1H, с., 2H); 8,18 (1H, кв., 5H); 7,70+7,67 (2H, с.+с., 3´H+5´H); 7,51+7,48 (2H, с.+с., 2´H+6´H); 7,267,37 (2H, м., 8H+6H). |
1,31 (6H, с., СH(СH3)2); 1,91+2,12 (4H, д.+кв., N(CH2СH2)2CH); 2,43+3,90 (4H, т.+д., N(CH2СH2)2CH); 3,05 (1H, квинтет, СH(СH3)2); 4,59 (1H, т., N(CH2СH2)2CH). |
|
4.3 |
8,43 (1H, с., 2H); 8,19 (1H, кв., 5H); 7,83 (1H, д., 6´H); 7,56 (1H, т., 5´H); 7,28-7,38 (4H, м., 8H+6H+3´H+4´H). |
1,03 (3H, с., 2´СH3); 1,91+2,12 (4H, д.+кв., N(CH2СH2)2CH); 2,55+3,59 (4H, т.+д., N(CH2СH2)2CH); 4,62 (1H, т., N(CH2СH2)2CH). |
|
4.4 |
8,43 (1H, с., 2H); 8,12-8,22 (3H, 5H+2´H+6´H); 7,88+7,91 (2H, с.+с., 3´H+5´H); 7,26-7,37 (2H, м., 8H+6H). |
1,40 (3H, т., 4´CO2CH2СHд); 1,91+2,24 (4H, д.+кв., N(CH2СH2)2CH); 2,43+3,90 (4H, т.+д., N(CH2СH2)2CH); 4,41 (2H, кв., 4´CO2CH2СH3); 4,61 (1H, т., N(CH2СH2)2CH). |
|
4.5 |
8,45 (1H, с., 2H); 8,18 (1H, кв., 5H); 7,59 (1H, т., 4´H); 7,45 (2H, с., 2´H+6´H); 7,28-7,37 (2H, м., 8H+6H). |
1,91+2,24 (4H, д.+кв., N(CH2СH2)2CH); 2,57+3,90 (4H, т.+д., N(CH2СH2)2CH); 4,62 (1H, т., N(CH2СH2)2CH). |
|
4.6 |
8,43 (1H, с., 2H); 8,19 (1H, кв., 5H); 7,24-7,40 (3H, м., 8H+6H+6´H); 7,17 (2H, с., 3´H+4´H). |
1,90+2,16 (4H, д.+кв., N(CH2СH2)2CH); 2,76+3,90 (4H, т.+д., N(CH2СH2)2CH); 3,80+3,87 (6H, с.+с. 2´ОСH3+5´ОСH3); 4,61 (1H, т., N(CH2СH2)2CH). |
|
4.7 |
8,46 (1H, с., 2H); 8,18 (1H, кв., 5H); 7,68+7,66 (2H, с.+с., 2´H+6´H); 7,48+7,46 (2H, с.+с., 3´H+5´H); 7,347,44 (2H, м., 8H+6H). |
1,90+2,19 (4H, д.+кв., N(CH2СH2)2CH); 2,36+3,82 (4H, т.+д., N(CH2СH2)2CH); 2,41 (3H, с. 4´СH3); 4,51 (1H, т., N(CH2СH2)2CH). |
|
4.8 |
8,46 (1H, с., 2H); 8,19 (1H, кв., 5H); 7,51 (1H, д., 3´H); 7,28-7,37 (2H, м., 8H+6H); 7,18-7,26 (2H, м., 5´H+6´H). |
1,91+2,17 (4H, д.+кв., N(CH2СH2)2CH); 2,57+2,40 (6H, с.+с., 2´СH3+4´СH3); 2,75+3,80 (4H, т.+д., N(CH2СH2)2CH); 4,61 (1H, т., N(CH2СH2)2CH). |
|
4.9 |
8,40 (1H, с., 2H); 7,60-7,80 (5H, м., |
1,91+2,17 (4H, д.+кв., N(CH2СH2)2CH); 2,37+3,85 (4H, т.+д., |
При изучении биологической активности синтезированных соединений методом in silico по данным прогноза программой PASS (http://www.pharmaexpert.ru/passonline/) было установлено, что большинство из них обладают ноотропной (около 84%) и анальгетической (74%) активностью. Следует отметить, что соединениям с атомом фтора в положении 6 хиназолинового цикла характерна наибольшая ноотропная активность среди прочих соединений данного ряда. Полученные данные свидетельствуют о том, что полученные в ходе работы соединения могут быть перспективным для поиска среди них новых обезболивающих средств, или средств, улучшающих мозговую активность. По результатам проведенных микробиологических исследований было установлено, что большинство бактерий умеренно чувствительны к действию соединений данного ряда, однако они не угнетали роста грибов Candida albicans. Результаты микробиологических исследований приведены в таблице 5.
|
5Н+7Н+8Н+2´Н+6´Н); 7,14+7,17 (2Н, с.+с., 3´Н+5´Н). |
N(CH2СH2)2CH); 3,90 (3Н, с. 4´OСН3); 4,55 (1Н, т., N(CH2СH2)2CH). |
|
|
4.10 |
8,39 (1Н, с., 2Н); 7,60-7,80 (5Н, м., 5Н+7Н+8Н+2´Н+6´Н); 7,44+7,47 (2Н, с.+с., 3´Н+5´Н). |
1,92+2,22 (4Н, д.+кв., N(CH2СH2)2CH); 2,37+3,85 (4Н, т.+д., N(CH2СH2)2CH); 2,45 (3Н, с. 4´СН3); 4,55 (1Н, т., N(CH2СH2)2CH). |
|
4.11 |
8,39 (1Н, с., 2Н); 7,78 (1Н, д., 5Н); 7,57-7,74 (1Н, м., 7Н); 7,63 (1Н, т., 8Н); 7,25 (1Н, с., 6´Н); 7,17 (2Н, с., 3´Н+4´Н). |
1,89+2,17 (4Н, д.+кв., N(CH2СH2)2CH); 2,74+3,90 (4Н, т.+д., N(CH2СH2)2CH); 3,78+3,90 (6Н, с.+с. 2´ОСН3+5´ОСН3); 4,62 (1Н, т., N(CH2СH2)2CH). |
|
4.12 |
8,35 (1Н, с., 2Н); 7,58-7,78 (5Н, м., 5Н+7Н+8Н+2´Н+6´Н); 7,51+7,49 (2Н, с.+с., 3´Н+5´Н). |
1,27 (6Н, с., СН(СН3)2); 1,89+2,25 (4Н, д.+кв., N(CH2СH2)2CH); 2,43+3,88 (4Н, т.+д., N(CH2СH2)2CH); 3,06 (1Н, квинтет, СН(СН3)2); 4,62 (1Н, т., N(CH2СH2)2CH). |
|
4.13 |
8,41 (1Н, с., 2Н); 7,77 (1Н, д., 5Н); 7,60-7,74 (5Н, м., 7Н+8Н+2´Н+5´Н+6´Н). |
1,89+2,23 (4Н, д.+кв., N(CH2СH2)2CH); 2,45+3,88 (4Н, т.+д., N(CH2СH2)2CH); 2,45 (3Н, с. 4´СН3); 4,60 (1Н, т., N(CH2СH2)2CH). |
|
4.14 |
8,39 (1Н, с., 2Н); 7,77 (1Н, д., 5Н); 7,60-7,74 (2Н, м., 7Н+8Н); 7,34 (1Н, с., 4´Н); 7,37 (2Н, с., 2´Н+6´Н). |
1,85+2,24 (4Н, д.+кв., N(CH2СH2)2CH); 2,40+3,86 (4Н, т.+д., N(CH2СH2)2CH); 2,42 (6Н, с., 3´СН3+5´СН3); 4,53 (1Н, т., N(CH2СH2)2CH). |
|
4.15 |
8,39 (1Н, с., 2Н); 7,58-7,78 (3Н, м., 4´Н+7Н+8Н); 7,88-8,12 (4Н, м., 5Н+2´Н+5´Н+6´Н). |
1,92+2,24 (4Н, д.+кв., N(CH2СH2)2CH); 2,51+3,91 (4Н, т.+д., N(CH2СH2)2CH); 4,61 (1Н, т., N(CH2СH2)2CH). |
|
4.16 |
8,46 (1Н, с., 2Н); 8,07 (1Н, с., 5Н); 7,69 (1Н, с., 2´Н); 7,46-7,76 (4Н, м., 5´Н+6´Н+7Н+8Н). |
1,85+2,18 (4Н, д.+кв., N(CH2СH2)2CH); 2,35 (3Н, с., 4´СН3); 2,47+3,70 (4Н, т.+д., N(CH2СH2)2CH); 4,57 (1Н, т., N(CH2СH2)2CH). |
|
4.17 |
8,49 (1Н, с., 2Н); 8,09 (1Н, с., 5Н); 7,77-7,82 (1Н, м., 7Н); 7,64-7,70 (1Н, м., 8Н). |
1,28 (3Н., т., CH2СЩ; 1,91+2,15 (4Н, д.+кв., N(CH2СH2)2CH); 3,07 (2Н, кв., CH2СН3); 3,07+3,82 (4Н, т.+д., N(CH2СH2)2CH); 4,78 (1Н, т., N(CH2СH2)2CH). |
|
4.18 |
8,50 (1Н, с., 2Н); 8,23 (1Н, т., 5Н); 7,30-7,42 (2Н, м., 6Н+8Н). |
1,95+2,18 (4Н, д.+кв., N(CH2СH2)2CH); 2,90 (3Н., с., СН3); 2,95+3,78 (4Н, т.+д., N(CH2СH2)2CH); 4,77 (1Н, т., N(CH2СH2)2CH). |
|
4.19 |
8,49 (1Н, с., 2Н); 8,22 (1Н, т., 5Н); 7,30-7,42 (2Н, м., 6Н+8Н). |
1,28 (3Н., т., CH2СВД; 1,91+2,15 (4Н, д.+кв., N(CH2СH2)2CH); 3,08 (2Н, кв., CH2СН3); 3,07+3,82 (4Н, т.+д., N(CH2СH2)2CH); 4,78 (1Н, т., N(CH2СH2)2CH). |
Таблица 5 - Данные микробиологических исследований синтезированных соединений 4.1-4.19.
|
Среднее значение зоны задержки роста, мм; n=3* |
||||||
|
S. aureus |
E. coli |
P. vulgaris |
Ps. aeruginosa |
B. subtilis |
C. albicans |
|
|
**М |
14 |
14 |
- |
- |
16 |
14 |
|
***С |
14 |
17 |
17 |
17 |
17 |
|
|
4.1 |
14 |
14 |
13 |
13 |
15 |
|
|
4.2 |
15 |
15 |
13 |
13 |
15 |
|
|
4.3 |
15 |
16 |
13 |
14 |
16 |
|
|
4.4 |
15 |
15 |
13 |
13 |
16 |
|
|
4.5 |
15 |
15 |
14 |
13 |
16 |
|
|
4.6 |
15 |
15 |
13 |
13 |
16 |
|
|
4.7 |
17 |
16 |
13 |
13 |
15 |
|
|
4.8 |
16 |
15 |
13 |
13 |
15 |
|
|
4.9 |
15 |
15 |
13 |
13 |
14 |
|
|
4.10 |
14 |
14 |
13 |
13 |
15 |
|
|
4.11 |
18 |
18 |
13 |
13 |
16 |
|
|
4.12 |
16 |
16 |
13 |
13 |
16 |
|
|
4.13 |
15 |
16 |
13 |
13 |
14 |
|
|
4.14 |
15 |
16 |
13 |
13 |
16 |
|
|
4.15 |
15 |
16 |
12 |
13 |
15 |
|
|
4.16 |
16 |
15 |
13 |
13 |
15 |
|
|
4.17 |
17 |
16 |
13 |
13 |
16 |
|
|
4.18 |
16 |
15 |
13 |
13 |
16 |
|
|
4.19 |
16 |
14 |
14 |
14 |
16 |
|
«-» - отсутствие антимикробного действия;
*В таблице приведены средние значения для 3-х экспериментов.
**М. - метронидазол (раствор в ДМСО, концентрация 30 мкг/мл);
***С. - синтомицин (раствор в Н2О, концентрация 30 мкг/мл).
Проведенный литературный поиск, обосновывает ил)хиназолин-4(3Н)-она и его структурных аналогов. В ходе актуальность развития химии 3-(пиперидин-4- проведенных исследований было получено 19 новых, ранее
Благодарность.
не описанных в литературе 3-[1- (арил(алкил)сульфонил)пиперидин-4-ил]хиназолин-4(3H)- онов, для которых были изучены их химические, спектральные свойства, а также биологическая активность. Проведенные исследования по определению биологической активности позволили установить, что большинство тест- штаммов бактерий умеренно чувствительны к действию соединений данного ряда. В то же время результаты прогноза по программе PASS указывают на высокую вероятность ноотропной активности для полученных 3-[1- (арил(алкил)сульфонил)пиперидин-4-ил]хиназолин-4(3H)- онов.
Авторы благодарны зав. лабораторией биохимии микроорганизмов и питательных сред ГУ «ИМИ им. И.И. Мечникова НАМНУ» (г. Харьков), кандидату биологических наук, старшему научному сотруднику Осолодченко Татьяне Павловне за проведение изучения противомикробной активности синтезированных соединений.
СПИСОК ЛИТЕРАТУРЫ
- Пат. US8846702 B2 (2014). - Заявл.: 26.08.2010. Опубл.: 30.09.2014;
- Kim D. Potent 1,3,4-trisubstituted pyrrolidine CCR5 receptor antagonists: effects of fused heterocycles on antiviral activity and pharmacokinetic properties // Bioorg. Med. Chem. Lett. - 2005. - 15. - Р. 2129-2134.
- Пат. US6235730 B1 (2001). - Заявл.: 11.12.1998. Опубл.: 22.05.2001;
- Пат. US4166117 A (1979). - Заявл.: 11.07.1977. Опубл.: 28.08.1979;
- Пат. WO1995015961 A1 (1995). - Заявл.: 02.12.1994. Опубл.: 15.06.1995;
- Пат. WO2012087938 A1 (2012). - Заявл.: 19.12.2011. Опубл.: 28.06.2012;
- King, F. D. Benzotriazinones as virtual-ring mimics of o-methoxybenzamides: novel and potent 5-HT3 receptor antagonists // J. Med. Chem. - 1990. - 33. - Р. 2942-2944.
- Пат. WO2008094909 A3 (2010). - Заявл.: 29.01.2008. Опубл.: 11.03.2010;
- Пат. WO2011143444 A2 (2011). - Заявл.: 12.05.2011. Опубл.: 17.11.2011;
- Пат. WO2007104034 A3 (2008). - Заявл.: 08.03.2007. Опубл.: 28.02.2008;
- Wayne, P. A. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing // Twenty- Second Informational Supplement. Document // CLSI, Wayne, P. A. - January, 2012. -Vol. 32. - No. 3. - Р. 100-122.
- Colyle M.B. Manual of Antimicrobial Susceptibility Testing // American Society for Microbiology. - Washington: 2005. - Р. 18-22.