Сепсис является одной из лидирующих причин смерти по всему миру. Так как при сепсисе отсутствуют специфические клинические симптомы и признаки, то диагностика его затруднена. В связи с этим постоянно возникает потребность в ранней диагностике сепсиса и его адекватной терапии. В связи с этим, для диагностики и контроля лечения сепсиса предложено более 100 биологических маркеров. В настоящее время наиболее ценными и часто используемыми в клинической практике являются прокальцитонин (ПКТ), липополисахарид- связывающий белок, интерлейкин-6 и С-реактивный белок (СРБ). Для объективной оценки тяжести состояния септических пациентов применяются общеизвестные шкалы SOFА, SAPS-II, а также показатели качественного и количественного состава лейкоцитов, уровень белков острой фазы воспаления (фибриноген).
Актуальность.
Cогласно данным многих исследований, инфекционными болезнями заболевают 50-60% госпитализированных доношенных и 70% недоношенных новорожденных [14]. Сепсис занимает одной из первых позиции причин смерти по всему миру — смертность от этого заболевания у детей и взрослого населения превышает число смертности от инфаркта миокарда, раковых заболеваний и инсульта [15]. Неонатальный сепсис (НС) остается одной из основных причин заболеваемости и смертности у новорожденных, особенно у недоношенных новорожденных [ 16]. Уровень смертности у новорожденных с очень низкой массой тела при рождении может превышаться до 60-70% (<1500 г) [ 17 ]. Помимо того он может вызвать осложнения у выживших и значительно ухудшает неврологический исход [18, 19]. Так как болезнь может быстро прогрессировать до синдрома полиорганной недостаточности и септического шока, и ранняя диагностика имеет большое значение для улучшения выживаемости. К сожалению, поставить диагноз сепсиса у новорожденных может иметь определенные затруднения. Самые ранние признаки болезни часто являются тонкими и неспецифическими, их легко спутать с признаками неинфекционных заболеваний [ 16]. При развитии сепсиса ПСП повышается через один час после появления в крови инфицирующих агентов, то есть раньше, чем СРБ и ПКТ. В недавно опубликованных результатах клинических исследований, выполненных в отделениях неотложной и интенсивной терапии в Китае, Италии и Японии, показано, что ПСП является наиболее эффективным биомаркером диагностики сепсиса, прогнозирования его течения, ранней стратификации и мониторинга тяжелых септических пациентов. других аналогичных инструментов. Применение в лабораториях биомаркеров для диагностики НС и прогнозирования его течения имеет не малые ограничения. Основной причиной является задержка результатов из центральной лаборатории. На данный момент нет других биомаркеров, сравнимых с ПСП, по его одновременному диагностическому и прогностическому потенциалу, пригодному для точной стратификации септических пациентов Неонатальный сепсис (НС)- септический процесс, протекающий в течение первых 28 дней жизни у доношенных и недоношенных новорожденных. Согласно статистике, во всем мире в среднем заболеваемость НС достигает от 1 до 20 случаев на 1000 живых рождений и может сильно зависеть от конкретных социально-экономических условий, при этом смертность от НС составляет 13-70% [53].
Ссылаясь ранним исследования, которые проводились в Америке в 1993-2002 гг., частота неонатального сепсиса у доношенных новорожденных составляла 0,1¿ [54].
Согласно общепринятой классификации НС делится на ранний (РНС) и поздний (ПНС).
РНС развивается в первые 6 ч после рождения и манифестируется в первые 3 дня жизни. При этом, в первые 2 дня диагностируется 85¿ случаев РНС, а в период 24-48 ч-5¿, основной причиной РНС является инфицированность матери [55].
ПНС манифестируется после 3 дней жизни, и в 50¿ случаев является результатом нозокомиальных инфекций [1].
Ранняя диагностика и целенаправленная терапия новорожденных с сепсисом является ключевыми для предотвращения жизнеугрожающих осложнений и морбидности. Диагностика НС и его дифференциация от ССВО и от других морбидностей - является серьезной проблемой для лечащего врача. Считается, что для диагностики сепсиса необходимо наличие по крайней мере двух признаков ССВО, хоть положительные гемокультуры и наличие не менее двух признаков ССВО и считаются «золотым стандартом» диагностики сепсиса, но доверием они все же не пользуются. Для достаточно надежной и быстрой диагностики необходимы тесты in vitro. В настоящее время к более широко используемым маркерам относятся: количество лейкоцитов , количество бактерий, гемокультуры, ПЦР, Биохимические маркеры крови (ПКТ, СРБ, ИЛ-6, ИЛ-8, пресепсин (sCD14ST)
Авторы многих исследований сделали заключение, что «значительная доля детей с НС исходно имеет нормальный и низкий уровень СРБ (до 10 мг/мл), который связан с более низкой массой тела при рождении, с низким гистационным возрастом и более ранним началом развития сепсиса и инфицированностью коагулазо-отрицательным стафилококком» [9, 10, 11, 12]. Подчеркивается, что «плазменные уровни СРБ нельзя использовать ни для исключения сепсиса, подтвержденного гемокульутрами, ни для принятия решений об эмпирическом выборе антибиотиков» [13].
Прокальцитонин (ПКТ). Применение ПКТ для диагностики НС имеет такие же ограничения, как и применение СРБ. ПКТ также по физиологическим причинам, не связанным с инфекциями, повышается в первые 3 дня жизни. По мнению авторов [14], «высокий ПКТ у неинфицированных новорожденных частично может объясняться синдромом респираторного дистресса или гемодинамической недостаточностью» [15]. Применение ПКТ и результатов мета-анализов, авторы заключили, что «использование ПКТ как маркера неонатального сепсиса показало его умеренную точность вне зависимости от различных диагностических критериев сепсиса и времени измерения ПКТ»[16]. Они отметили, что «исходя из значительной статистической гетерогенности и отсутствия общепринятого определения НС, к интерпретации результатов данного мета-анализа следует относиться с должной осмотрительностью» [17].
С-реактивный белок (СРБ). Это один из главных центральных компонентов острой фазы воспалительного процесса. При развитии воспалений повышенный ИЛ-6, 8 и другие провоспалительные цитокины стимулируют синтез СРБ в печени (пик концентрации достигается через 2 дня), которое сопровождается активацией макрофагов и моноцитов, повышением фагоцитоза, повышенной продукций провоспалительных цитокинов [36]. Применение данного биомаркера для диагностики неонатального сепсиса в первые 72 ч. имеет большие ограничения, связанные с его нормальным физиологическим повышением у новорожденных детей. Таким образом, авторы отметили, что «значительная доля детей с НС исходно имеет нормальный и низкий уровень септической реакции (<10 мг/мл), который связан с наиболее низким ГВ, массой тела, и более ранним началом развития септического процесса». Подчеркивается, что «плазменные уровни СРБ нельзя использовать ни для исключения сепсиса, подтвержденного гемокульутрами, ни для принятия решений об эмпирическом выборе антибиотиков» [44].
Пресепсин (ПСП). P-SEP-новый высокочувствительный и высокоспецифичный маркер сепсиса, представляет собой белок, образуемый макрофагами при фагоцитозе инфицирующих бактерий и грибов [1]. Динамика показывает, что циркулирующие уровни ПСП повышаются при развитии системных инфекций (СИ) и сепсиса, вызываемых грамотрицательными, грамположительными и грибковыми инфекциями. ПСП имеет 100¿ чувствительность к подтвержденным гемокультурами инфекциям. Многократно было доказано, что при вирусных инфекциях, также воспалительных процессах, не связанных с СИ, динамика пресепсина остается стабильной [2].Он впервые был описан в 2005 г. исследователями из Медицинского университета Иватэ (Япония). Главную роль в образовании ПСП играет активация макрофагов- моноцитов, на
поверхности которых расположен мембранный рецепторный белок mCD14 с молекулярной массой 55 Кда. Рецепторный белок распознает сигнал о наличии инфицирующих бактерий, и тем самым включает воспалительный процесс и систему врожденного иммунитета [18-23]. Пресепсин повышается при грибковых, грамотрицательный, грамположительных и инфекциях (Coagulase-neg. Staphylococci, Klebsiella, Enterobacter, Serratia group, Pseudomonas,
Acinetobacter, и др.), не повышается при вирусных [18-23]. Уровни пресепсина не зависят: от пола, расы, способа родоразрешения, мало зависят от гестационного возраста, от близнецовости, от материнской лихорадки/повышенного СРБ, от мекониальных околоплодных вод
При исследовании, включавшем 119 130 новорожденных, было обнаружено, частота ПНС- 6,3 на 1000 поступлений в отделение интенсивной терапии (0,63 ¿) [2].
НС при очень низкой массе тела (ОНМТ). В ранних исследованиях у новорожденных, которые поступили в ОИНТН с ОНМТ (масса тела при рождении 1 000-1 500 г), частота сепсиса была ровна 11,0¿ [3].
Летальность от тяжелых инфекций при очень низкой массе составляло от 20 до 40¿ [4]. По данным других исследований, Смертность у новорожденных с ОНМТ и ПНС в среднем составляла ~18¿, при грам(-) сепсисе — 36¿ [5]. Недавние исследования показали, что новорожденные с ОНМТ и перенесшие ПНС страдают от неврологической и пульмонарной морбидности (18-36%) [6].
НС при экстремально низкой массе тела (ЭНМТ). Согласно раннему исследованию у новорожденных с ЭНМТ (масса тела при рождении 500-1 000 г) частота НС составляла 34,6¿ [3]. Сравнивая результаты различных исследований, касающиеся частоты РНС и ПНС у новорожденных с ОНМТ и ЭНМТ, появляются некоторые затруднения за счет гетерогенности исследованных групп , также различных диагностических критериев. Исходя из этого можно заключить, что:
Таблица 1.
- при очень низкой массе тела частота РНС =1 ¿, смертность = 25¿, для ПНС частота = 14-20%, смертность = 15-40%;
- при экстремально низкой массе тела частота НС = 35¿, частота РНС = 2¿; частота ПНС = 25-50%, смертность = 20-50%.
Чем меньше ГВ и масса тела при рождении, тем выше риск НС и его недоброжелательных исходов.
Гемокультуры в диагностике НС. Самый оптимальный объем образца должен составлять 6 мл, что неприемлемо для новорожденных с низкой масоой тела. Отрицательные гемокультуры — вовсе не гарантия отсутствия НС. С другой стороны, наличиеразличных бактерий в гемокультурах вполне может отражать бактериальную контаминацию или даже асимптоматическую бактериемию [7,8].
В первом исследовании было определение референтных уровней P-SEP, наблюдались 26 новорожденных детей, ГВ составлял 26-36 недель, которые в первые 24 ч. после рождения поступили в ОИТН с разными тяжелыми заболеваниями, но сепсиса отсутствовал. Средний уровень пресепсина составлял - 643,1 пг/мл, стандартное отклонение (СО) - 303,8 нг/л, медиана- 578 нг/л. Связь между гистационным возрастом и уровнями P-SEP не было обнаружено. Авторы подвели итог, что «указанные концентрации ПСП целесообразно использовать как референтные уровни для недоношенных новорожденных с гестационным возрастом 26-36 недель» [24].
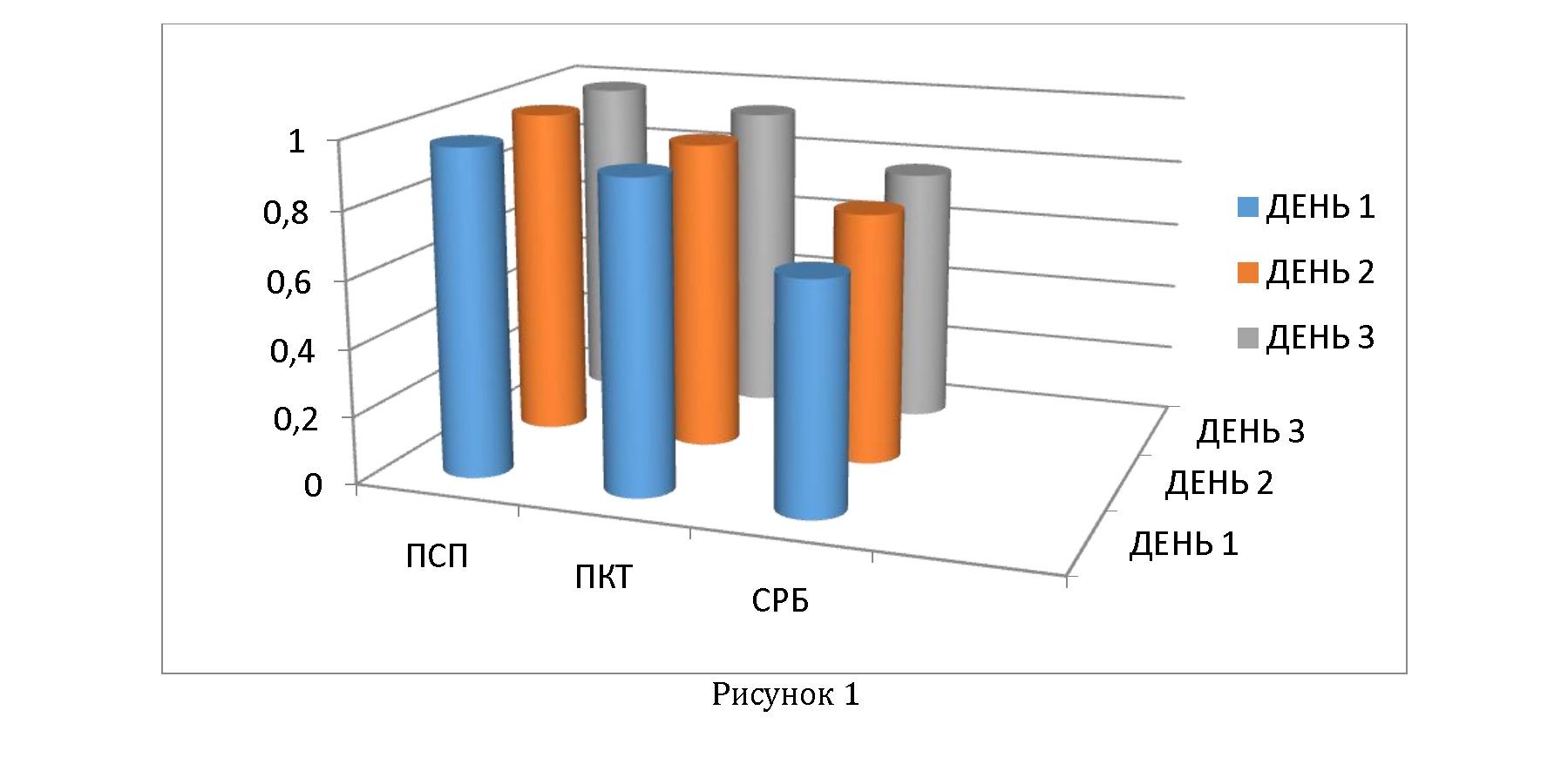 В следующих исследованиях наблюдались 188 новорожденных детей, поступивших в ОИТН: 24 из них с НС, 64 без НС. В течение первых 72 ч. измерялись уровни биомаркеров- СРБ, ПКТ и ПСП. Пограничные уровни для выявления НС в первые три дня составляли: для ПСП 781 пг/мл; для ПКТ 0,5 нг/мл и для СРБ 10 мг/л. Наиболее высокие значения в первые 24 ч. были у P-SEP. В целом значение AUC ROC составляло следующее (таблица 1, рисунок 1): Авторы заключили, что уже «в первый день поступления ПСП — более ранний, более чувствительный и более специфический маркер НС, чем ПКТ и СРБ. В целом, ПКТ — чувствительный и специфический маркер НС, повышается на поздних стадиях инфекции; СРБ — поздний и неспецифический маркер НС неонатального сепсиса, не способный дифференцировать бактериальную инфекцию от ССВО» [25].
В следующих исследованиях наблюдались 188 новорожденных детей, поступивших в ОИТН: 24 из них с НС, 64 без НС. В течение первых 72 ч. измерялись уровни биомаркеров- СРБ, ПКТ и ПСП. Пограничные уровни для выявления НС в первые три дня составляли: для ПСП 781 пг/мл; для ПКТ 0,5 нг/мл и для СРБ 10 мг/л. Наиболее высокие значения в первые 24 ч. были у P-SEP. В целом значение AUC ROC составляло следующее (таблица 1, рисунок 1): Авторы заключили, что уже «в первый день поступления ПСП — более ранний, более чувствительный и более специфический маркер НС, чем ПКТ и СРБ. В целом, ПКТ — чувствительный и специфический маркер НС, повышается на поздних стадиях инфекции; СРБ — поздний и неспецифический маркер НС неонатального сепсиса, не способный дифференцировать бактериальную инфекцию от ССВО» [25].
|
Биомаркеры |
день 1 |
день 2 |
день 3 |
|---|---|---|---|
|
ПСП |
0,97 |
0,98 |
0,98 |
|
ПКТ |
0,92 |
0,92 |
0,93 |
|
СРБ |
0,68 |
0,75 |
0,77 |
В недавнем исследовании наблюдали 40 новорожденных, поступивших в ОИТН с подозрением на НС, ГВ 37,5Ã1,23, масса тела при рождении 2 518,0Ã532,41 г. Уровни ПСП (пг/мл) составляли:
- в контрольной группе (n = 15) — 549,60;
- у всех пациентов (n = 40) — 1176,20;
- у пациентов с положительными гемокультурами (n = 23), установленный НС — 1453,78;
- у пациентов с отрицательными гемокультурами (n = 17), вероятный НС — 800,64;
- при РНС (n = 17) — 1 109,76;
- при ПНС (n = 23) — 1 225,30.
Тем самым, авторы заключили, что «ПСП — новый биомаркер с высокой чувствительностью и хорошей специфичностью, пригодный для ранней диагностики НС» [26].
Похожие данные были в относительно раннем исследовании, наблюдались 45 новорожденных детей. Уровни ПСП у детей без инфекций составляли 556Ã158 пг/мл. Было отмечено, что «измерение пресепсина в цельной крови новорожденных может использоваться для ранней диагностики РНС» [27].
А в недавнем специальном исследовании наблюдались 28 новорожденных с поздним неонатальным сепсисом, ГВ 37,6Ã1,7 недели, масса составляла 3 242Ã269 г, 16 (57 ¿) детей с /Á гемокультурами, контрольная группа — 3/4 здоровых новорожденных, ГВ составлял - 38,3 Ã 1,3; масса тела - 3198Ã235 г. Уровни маркеров:
- P-SEP(пг/мл) — у пациентов 872,6 Ã 234,1; в контроле 379,8Ã127,3;
- CRP (мг/л) — у пациентов 58,3Ã49,2; в контроле 2,6Ã1,7. При эффективной АБТ ПСП снижался от 872,6 Ã 234 до 325,1 Ã 87,2 пг/мл, а СРБ от 58,3 Ã 49,2 мг/л до 17,2Ã3,24.
Составлены диагностические характеристики для выявления РНС (таблица 2).
Таблица 2
|
Биомаркеры |
Пограничный уровень; пг/мл. |
AUC ROC |
Чувствительность |
Специфичность |
Отрицательное предиктивное |
Положителное предиктивное значение |
|
P-SEP |
672 |
0,95 |
97 % |
98 % |
92 % |
96 % |
|
CRP |
8,12 |
0,67 |
58 % |
92 % |
72 % |
84 % |
Сходные данные были получены, когда наблюдали 49 новорожденных, поступивших в ОИТН с установленным или подозреваемым сепсисом, контрольная группа — 21 здоровых новорожденный. Уровни P-SEP (пг/мл, медиана) составляли: в группе пациентов 2 879 (медиана), в контроле 686; уровни СРБ (мг/л, медиана) составляли 6,0, а в контроле 0,0. У пациентов с Á (n = 31) и - (n = 14) гемокультурами уровни пресепсина - 2 879 пг/ мл и 2 624 пг/ мл , уровни С-реактивного белка — 10,0 мг/л и 6,0 мг/л соответственно. Уровни ПСП составляли: при РНС (n = 28) 2 489 пг/мл, при ПНС (n = 21) 3 647 пг/мл; уровни СRP 6,0 и 10,0 мг/л соответственно. Для диагностики неонатального сепсиса диагностические характеристики пограничного уровня ПСП 1 807,5 пг/мл имели чувствительность 85,2 ¿, специфичность 72,2 ¿, AUC ROC 0,784 и превышали таковые для СРБ при пограничном уровне 2 мг/л, составлявшие 65,3 ¿, 71,4 ¿ и 0,659 соответственно [29].
Аналогичные результаты были получены в недавнем исследовании 124 новорожденных детей: 41 с сепсисом, ГВ 36,2 Ã 3,3 (29-41) недели, масса тела 2 495 Ã 830 г. У всех детей с НС были(Á) гемокультуры, у 33 детей грам(Á), у 6 грамм(-); были признаки воспаления в двух органах: были пневмония, гипрегликемия, инфекции мочевого тракта, гнойный менингит, тромобоцитопения, анемия, метаболический ацидоз, гипербилирубинемия и повышенные уровни СРБ, ПКТ.
Уровни P-SEP не зависели ГВ, от пола, асфиксии и родоразрешения. Уровни CRB и PCT между группами с сепсисом и с локальными инфекциями также не различались. Был предложен пограничный уровень ПСП для диагностики НС — 1 066 пг/мл, специфичность 89,2 ¿, чувствительность 63,4 ¿. Исследователи заключили, что «ПСП может использоваться как высокоспецифичный биомаркер для ранней диагностики раннего и позднего НС и также для тяжелых локальных инфекций» [30].
В более масштабном исследовании, наблюдали новорожденных детей, разделенные на 3 группы: группа I — контрольная, группы II и III — новорожденные, которые поступили в ОИТН (таблица 3).
Таблица 3.
|
Группа |
N |
дети |
ГВ |
масса при рождении |
Уровни ПСП; пг/мл. |
|
1 |
487 |
здоровые доношенные |
38,9 недель |
3 211 Ã 417,6 г. |
650,17 |
|
2 |
160 |
недоношенные без клинических признаков сепсиса |
33,9 ã 2,5 недели |
2 052,2 Ã 594,8 г. |
722,32 |
|
3 |
42 |
доношенные и недоношенные |
32,4 Ã 5,9 недели |
1 811 Ã 1 204 г. |
При поступлений- 1 243,05; При АБТ - 754,41 |
В ходе исследования один ребенок умер, ПСП перед смертью - 1 888 пг/мл. Дети с подтвержденным сепсисом по сравнению с детьми, имевшими только клинические признаки сепсиса, характеризовались малым ГВ (31,5 Ã 5,7 против 33,3 Ã 6,1 недели) и более низкой массой при рождении (1 501,3 Ã 1 039) против 2 064,2 Ã 1 262,4 [31]. Показательно недавнее исследование, в котором наблюдали 65 критически больных доношенных и недоношенных новорожденных, поступивших в ОНТН, которые были разделены на 3 группы. Группа A. 25 детей с бактериальными РНС и ПНС, подтвержденными положительными гемокультурами, ГВ 35,0 (31,041,0) недель, масса при рождении 2 507,5 (1 295-3 160) г, получали АБТ. Уровни ПСП составляли 1 000 (862-1 212) пг/мл, СРБ 21,1 (6,0-55,9) мг/л. Группа B. 15 детей с небактериальным ССВО, ГВ 34,0 (28,8-34,0) недели, масса при рождении 1 550 (912-1 960) г, ПСП 992 (737-1 585) пг/ мл, СРБ 8,0 (4,8-16,7) мг/л. Группа C. 25 детей без клинических или бактериологических признаков системной или локальной инфекции, ГВ 34,0 (29,0-36,0) недели, масса при рождении 1 750 (1 027-3 000) г, ПСП 453 (309-526) пг/мл, СРБ 3,1 (1,05,2) мг/л. Анализ показал, что ПСП имеет более высокую точность для дискриминации детей с НС от контрольной группы, чем СРБ, значения AUC ROC которых составляли 0,995 против0,827 соответственно. ПСП при пограничном уровне 540 пг/мл для диагностики НС имел чувствительность 100 ¿ и специфичность 81,2 ¿. Авторы особо подчеркивают, что «для выяснения того, как на уровни ПСП влияют тяжелые неонатальные вирусные инфекции, нужны специальные исследования, и что гемокультуры не отвечают требованиям „золотого“ стандарта, так как могут давать значительное количество ложноотрицательных результатов, особенно у новорожденных, для которых доступны только малые объемы образцов крови». Авторы пришли к выводу, что «ПСП может быть внедрен в клиническую практику как диагностический инструмент для улучшения диагностики и терапии НС и небактериального ССВО» [32].
ПСП при диагностике ПНС у недоношенных новорожденных. Особую опасность представляет ПНС у недоношенных детей. В предварительном исследовании наблюдались 19 новорожденных (ГВ 25,6 Ã 2,0 недели), масса тела 684 Ã 215 г. Из них 79 ¿ находились на ИВЛ, длительность пребывания в ОИТН 54 Ã 28 дней. Контрольная группа: новорожденные без инфекций (ГВ 28,8 Ã 2,0 недели), масса при рождении 1 021 Ã 233 г, 33 ¿ находились на ИВЛ, пребывание в ОИТН 35 Ã 18 дней. Уровни ПСП (медиана) составляли: • при поступлении — с сепсисом 1 295 против 562 пг/мл в контроле; • через один день — при сепсисе и эффективной АБТ ПСП понизился до 1 011 пг/мл (уровни ПКТ и СРБ при АБТ через один день не понижались). Для диагностики ПНС у недоношенных новорожденных предложен пограничный уровень ПСП 885 пг/мл, чувствительность 94 ¿ (95 ¿ ДИ 74- 100 %), специфичность 100 ¿ (95¿ ДИ 84-100 %), AUC ROC 0,972 [33].
Исходя из этих данных можно выявить предварительные пограничные уровни ПСП для диагностики неонатального сепсиса (таблица 4).
Таблица 4.
|
Референтный уровень; пг/мл |
Исследованная когорта |
AUC ROC |
Источники |
|
650±258 |
487 здоровых новорожденных |
Pugni et al. |
|
|
722±338 |
168 недоношенных без признаков сепсиса |
||
|
562 |
21 здоровых новорожденных 19 случаев с ПНС |
0,97 (1 день) 0,98 (2 день) 0,98 (3 день) |
Poggi et al. |
|
781 |
64 здоровых новорожденных 122 инфицированных новорожденных |
AbdElaziz H. |
|
|
643 ±304 |
26 здоровых недоношенных |
Mussap et al. |
|
|
556±158 |
18 новорожденных с факторами риска, но с исключенным сепсисом |
Kwiatkowska-Gruca et al. |
В дальнейших исследованиях наблюдались 42 недоношенных новорожденных с ПНС, ГВ 28,4 Ã 2,6 недели, масса при рождении около 1 100 г,
контрольная группа 40 здоровых новорожденных, ГВ 28,9 Ã 2,8 недели, масса при рождении около 1 100 г. Уровни ПСП (пг/мл) составляли:
- при ПНС — 1 024 (295-8 202);
- без ПНС — 530 (190-782);
- при грамотрицательной инфекции — 1 200 (438-2 228);
- при грамположительной инфекции — 1 100 (295-4 785).
У выживших детей уровни ПСП составляли 932 (2958 202), у не выживших — 1 368 (826-5 078) пг/мл. Динамика ПСП (пг/мл) при эффективной АБТ была следующей:
- при поступлении — 1 024 (295 8 202),
- на третий день — 717 (213 4 200);
- на седьмой день — 442 (199 901).
Пограничный уровень ПСП для диагностики ПНС у недоношенных новорожденных составлял 800,5 пг/мл, чувствительность 67 ¿, специфичность 100 ¿ [34]. По мнению авторов, P-SEP может быть использован в качестве надежного биологического маркера НС и как реакция на лечение у недоношенных детей. Тем не менее, исследования не продемонстрировали эффективность ПСП для выявления тяжести заболевания или предварительного прогноза [35].
Для точного определения референтных уровней данного биомаркера В Италии в NUoF (Neonatal Unit of Fondazione IRCCS) проводилось исследование e 684 новорожденных. Анализы проб крови для определения ПСП отбирались: у доношенных на 3,6 (СО 0,6) день после рождения; у недоношенных новорожденных на 3,9 (СО 0,8) день после рождения. А в целом средние уровни ПСП (пг/мл) составляли: • у доношенных — 649 (СО 257), у недоношенных — 720 (СО 329).
Медианные уровни ПСП (пг/мл) составляли:
- у 484 (70,8 ¿) доношенных новорожденных — 603,5 пг/мл, межквартальный диапазон 466-791 пг/мл, 5я и 95-я процентили — 315 и 1 178 пг/мл соответственно;
- у 200 (29,2 ¿) недоношенных новорожденных (ГВ 24-36 недель) — 620 пг/мл, межквартальный диапазон 503-864 пг/мл, 5-я и 95-я процентили — 352 и 1 370 пг/мл соответственно.
Достоверной связи между уровнями ПСП и ГВ, массой при рождении, постнатальным возрастом, нормальным или патологическим статусом матери и другими клиническими переменными обнаружено не было. Отмечается, что большинство физиологических характеристик новорожденных, которые влияют на уровни СРБ и ПКТ, на уровни ПСП не влияли. Таким образом в 2005 году Yaegashi и другие авторы [36] заключили: «ПСП может быть высокоэффективным маркером неонатального сепсиса, также может способствовать диагностики ПСП у взрослого населения» [35-49].
Предварительные референтные уровни ПСП для диагностики НС здоровые новорожденные: ниже 600 пг/мл. Риск развития НС: 600-800 пг/мл. Септические новорожденные: выше 800 пг/мл [50, 51].
Измерение ПСП в ликворе новорожденных. Весьма принципиальными оказались результаты измерения ПСП в спинномозговой жидкости (СМЖ) новорожденных. Наблюдались новорожденные (n = 25, возраст 12 Ã 7 суток), которым по показаниям со стороны ЦНС (синдром угнетения, судорожный синдром) или в связи с повышением температуры тела без уточненного очага инфекции с целью исключения менингита проводилась люмбальная пункция. В СМЖ исследовались количество и состав клеточных элементов, уровень глюкозы и белка, а также проводилось определение уровня ПСП. Обнаружено, что большинство детей (n = 22) не имели лабораторных признаков менингита. Количество клеток в 1 мкл СМЖ у новорожденных данной группы зарегистрировано в пределах 9,76 Ã 4,30; из них 4,38 Ã 1,86 нейтрофилов в 1 мкл. Авторы полагают, что «полученные результаты позволяют говорить о повышении уровня ПСП в СМЖ у новорожденных детей с диагнозом „гнойный менингит“» [52].
Следующим исследованием этих же самых ученых было определение уровня sCD14-ST у доношенных новорожденных в позднем неонатальном периоде. Исследование включало доношенных новорожденных детей, поступивших в стационар на 2-3 неделе жизни по экстренному случаю с проявлениями бактериальных или вирусных инфекций. Новорожденные были разделены на 2 группы: 1) 50 детей- с вирусными или бактериальными инфекциями; 2) 8 детей- с бактериальными инфекциями. Результаты исследования: уровень ПСП в 1 группе: медиана - 291,00 pg/ml, 5-ый перцентиль - 152,20 pg/ml; 95-ый перцентиль - 860,00 pg/ml ; во второй группе оказался несколько выше: медиана - 359,0 pg/ml; 5ый перцентиль - 252,0 pg/ml; 95-ый перцентиль - 1302,0 pg/ml). Сепсис был диагностирован лишь у одного ребенка 2 группы. Авторы установили параметры колебаний уровня пресепсина у доношенных детей, поступивших в стационар в ПНП по экстренным показаниям с проявлениями вирусных или бактериальных инфекций [52].
Вывод.
В отличие от СРБ и ПКТ референтые уровни ПСП у новорожденных практически не зависят от гестационного возраста, от массы тела при рождении, от способа родоразрешения и от раннего постнатального возраста. У септических доношенных новорожденных, а также у септических недоношенных новорожденных с ОНМТ и ЭНМТ пограничные диагностические уровни ПСП составляют более 800 пг/мл. ПСП как ранний маркер РНС и ПНС имеет более высокие значения чувствительности и специфичности, чем СРБ и ПКТ. При мониторинге терапии НС ПСП отражает степень ее эффективности быстрее и надежнее, чем СРБ и ПКТ. В заключении можно сделать следующие вывод: Инфекции ПСП возрастает очень быстро, что позволяет выявлять состояния, связанные с высоким риском и на очень ранних стадиях назначать целенаправленную терапию.
Данных о повышении ПСП в отличие от СРБ и ПКТ, связанном с другими коморбидностями или с варьирующими неонатальными факторами, нет.
Уровни ПСП не зависят от возраста и пола новорожденных
Повышение ПСП является специфическим для бактериального, но не для вирусного сепсиса
Практическое преимущество: малое количество образца
Необходимо 75-100 мкл ЭДТА-крови, центрифугирование не нужно
Отличная точность полностью автоматизированного метода измерения гарантирует быстрое получение надежных количественных результатов
Отличная специфичность и чувствительность ПСП позволяет принимать обоснованные клинические решения о назначении или отмене антибиотикотерапии.
СПИСОК ЛИТЕРАТУРЫ
- Shane AL, Stoll BJ. Neonatal sepsis: Progress towards improved outcomes // J Infect. - 2014. - №68. - Suppl.1. - Р. 24-32.
- Cohen-Wolkowiez M, Moran C, Benjamin DK et al. Early and late onset sepsis in late preterm infants.Pediatr // Infect. Dis. J. - 2009. - №28(12). - Р. 1052-1056.
- Stoll BJ, Hansen N. Infections in VLBW infants: studies from the NICHD Neonatal Research Network // Semin. Perinatol. - 2003. - №27(4). - Р. 293-301.
- Haque K. Definitions of bloodstream infection in the newborn // Pediatr. Crit. Care. Med. - 2005. - №6. - suppl.3. - Р. 4549.
- Stoll BJ, Hansen N, Fanaroff AA, et al. Late-onset sepsis in very low birth weight neonates: the experience of the NICHD Neonatal Research Network // Pediatrics. - 2002. - 110(2 Pt 1). - Р. 285-291.
- Pammi M1, Weisman LE. Late-onset sepsis in preterm infants: update on strategies for therapy and prevention. Expert Rev. Anti Infect. Ther. 2015, 13 (4): 487-504.
- Connell TG, Rele M, Cowley D, Buttery JP, Curtis N. How reliable is a negative blood culture result? Volume of blood submitted for culture in routine practice in a children's hospital // Pediatrics. - 2007. - 119 (5). - Р. 891-896.
- Kellogg JA, Ferrentino FL, Goodstein MH, Liss J, Shapiro SL, Bankert DA. Frequency of low level bacteremia in infants from birth to two months of age // Pediatr. Infect. Dis. J. - 1997. - №16. - Р. 381-385.
- Hofer N, Zacharias E, Müller W, Resch B. An update on the use of C-reactive protein in early onset neonatal sepsis: current insights and new tasks // Neonatology. - 2012. - №102. - Р. 25-36.
- Meem M, Modak JK, Mortuza R et al. Biomarkers for diagnosis of neonatal infections: a systematic analysis of their potential as a point-of-care diagnostics // J. Glob. Health. - 2011. - №1. - Р. 201-209.
- Hofer N, Zacharias E, Müller W, Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks // Neonatology. - 2012. - №102. - Р. 25-36.
- Dritsakou K, Liosis G, Gioni M, et al. CRP levels in extremely low birth weight (ELBW) septic infants // J. Matern. Fetal Neonatal Med. - 2015. - №28(2). - Р. 237-239.
- Lai MY, Tsai MH, Lee CW et al., Characteristics of neonates with culture-proven bloodstream infection who have low levels of C-reactive protein (≦10 mg/L) // BMC Infect Dis. - 2015. - №1. - Р. 88-96.
- Franz AR, Kron M, Pohlandt F et al. C-reactive protein and differential white blood cell count for the early diagnosis of bacterial infections in newborn infants // Pediatr. Infect. Dis. J. - 1999. - №18. - Р. 666-671.
- Lapillonne A, Basson E, Monneret G et al. Lack of specificity of procalcitonin for sepsis diagnosis in premature infants // Lancet. - 1998. - 351. - Р. 1211-1218.
- Yu Z, Liu J, Sun Q et al. The accuracy of the procalcitonin test for the diagnosis of neonatal sepsis: a meta-analysis // Scand. J. Infect. Dis. - 2010. - №42(10). - Р. 723-733.
- Vouloumanou EK, Plessa E, Karageorgopoulos DE, et al. Serum procalcitonin as a diagnostic marker for neonatal sepsis: a systematic review and meta-analysis // Intensive Care Med. - 2011. - №37. - Р. 747-762.
- Вельков В.В. Пресепсин — ранний и высо- коспецифичный маркер сепсиса: новые возможности // Клиниколабораторный консилиум. - 2014. - №3(50). - С. 8-28.
- Pizzolato E, Ulla M, Galluzzo C et al., Role of presepsin for the evaluation of sepsis in the emergency department // Clin. Chem. Lab. Med. - 2014. - №52(10). - Р. 1395-1400.
- Вельков В. В., Комплексная лаборатор- ная диагностика системных инфекций и сепсиса: С-реактивный белок, прокаль- цитонин, пресепсин. - М.: 2015. - 118 с.
- Использование биомаркера пресепсин для ранней и высокоспецифичной ди- агностики сепсиса // Клинические рекомендации Федерации лабораторной медицины РФ. 2014. Раны и раневые инфекции. - 2015. - №1. - С. 54-82. Chenevier-Gobeaux C, Didier D, Weiss N et al. Presepsin (sCD14-ST), an innate immune response.
- Erenler AK, Yardan T. Presepsin (sCD14-ST) as a biomarker of sepsis in clinical practice and in emergency department: a mini review // J. Lab. Med. - 2015. - №39. - Р. 11-17.
- Mussap M. et al. Soluble CD14 subtype (sCD14- ST) presepsin in critically ill preterm newborns: preliminary reference ranges // J. Matern. Fetal Neonatal Med. - 2012. - №25. - Suppl. 5. - Р. 51-53.
- Abd Elaziz H. Diagnosis of Neonatal using different sepsis markers. Abstract // 4th International Conference on Biomarkers and Clinical Research. - Philadelphia: 2013. - Р. 17-22.
- Osman AS, Awadallah MA, EL-Mageed Tabl HA et al. Presepsin as a Novel Diagnostic Marker in Neonatal Septicemia // Egyptian J. Med. Microbiol. - 2015. - №24. - Р. 21-26.
- Kwiatkowska-Gruca M et al. Presepsyna (rozpuszczalny podtyp CD14-ST) jako diagnostyczny biomarker posocznicy u noworodków // Pediatria Polska. - 2013. - №5. - Р. 392-397.
- Motalib TA, Fatma A Khalaf, FA et al. Soluble CD14-subtype (Prespsin) and Hepcidin as Diagnostic and Prognostic markers in Early Onset Neonatal Sepsis // Egyptian Journal of Medical Microbiology. - 2015.- №24. - Р. 45-52.
- Mostafa RM, Kholouss SM, Zakaria NM et al. Detection of Presepsin and Surface CD14 as a Biomarker For Early Diagnosis of Neonatal Sepsis // J. Am. Sci. - 2015. - №11(10). - Р. 104-116.
- Małgorzata S, Behrendt J, Szymańska A et al. Diagnostic Value of Presepsin (Scd14-St Subtype) Evaluation in the Detection of Severe Neonatal Infections // Int J Res Studies in Biosciences. - 2015. - №3. - Р. 110-116.
- Mussap M, Puxeddu E, Puddu M2 et al. Soluble CD14 subtype (sCD14-ST) presepsin in premature and full term critically ill newborns with sepsis and SIRS // Clin. Chim. Acta. - 2015. - №2. - Р. 45-52.
- Poggi C, Bianconi T, Gozzini E, et al. Presepsin for the detection of late-onset sepsis in preterm newborns // Pediatrics. - 2015. - 135(1). - Р. 68-75.
- Topcuoglu S, Arslanbuga C, Gursoy T et al. Role of Presepsin in the Diagnosis of Late-Onset Neonatal Sepsis in Preterm Infants // J. Matern. Fetal Neonatal Med. - 2015. - №2. - Р. 8-19.
- Sevilay Topcuoglu, Cansev Arslanbuga, Tugba Gursoy, Alev Aktas, Guner Karatekin, Ramazan Uluhan & Fahri Ovali. Role of presepsin in the diagnosis of late-onset neonatal sepsis in preterm infants. - 2015. - 1839 р.
- Yaegashi Y, Shirakawa K, Sato N, Suzuki Y, Kojika M, Imai S, et al. Evaluation of a newly identified soluble CD14 subtype as a marker for sepsis // J Infect Chemother. - 2005. - №11. - Р. 234-238.
- Pepys MB, Hirschfield GM. C-reactive protein: a critical update // J. Clin. Invest. - 2003. - №111. - Р. 1805-1812 Shozushima T, Takahashi G, Matsumoto N, Kojika M, Okamura Y, Endo S. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome // J Infect Chemother. - 2011. - №17. - Р. 764-769.
- Spanuth E, Ebelt H, Ivandic B, Werdan K. Diagnostic and prognostic value of presepsin (soluble CD14 subtype) in emergency patients with early sepsis using the new assay PATHFAST Presepsin [Abstract] // Advances in Clinical Chemistry and Laboratory Medicine. - 2012. - №2.- Р. 129-133.
- 40.Palmiere C, Mussap M, Bardy D, Cibecchini F, Mangin P. Diagnostic value of soluble CD14 subtype (sCD14-ST) presepsin for the postmortem diagnosis of sepsis-related fatalities // Int J Legal Med. - 2013. - №127. - Р. 799-808.
- Liu B, Chen YX, Yin Q, Zhao YZ, Li CS. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an emergency department // Crit Care. - 2013. - №17. - Р. 88-96.
- Ulla M, Pizzolato E, Lucchiari M, Loiacono M, Soardo F, Forno D, et al. Diagnostic and prognostic value of presepsin in the management of sepsis in the emergency department: a multicenter prospective study // Crit Care. - 2013. - №17. - Р. 168-175.
- Kweon OJ, Choi JH, Park SK, Park AJ. Usefulness of presepsin (sCD14 subtype) measurements as a new marker for the diagnosis and prediction of disease severity of sepsis in the Korean population // J Crit Care. - 2014. - №29. - Р. 965-970.
- Behnes M, Bertsch T, Lepiorz D, Lang S, Trinkmann F, Brueckmann M, et al. Diagnostic and prognostic utility of soluble CD 14 subtype (presepsin) for severe sepsis and septic shock during the first week of intensive care treatment // Crit Care. - 2014. - №18. - Р. 507-514.
- Masson S, Caironi P, Spanuth E, Thomae R, Panigada M, Sangiorgi G, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis: data from the Albumin Italian Outcome Sepsis trial. ALBIOS Study Investigators // Crit Care. - 2014. - №18. - Р. 52-55.
- Lai MY, Tsai MH, Lee CW et al., Characteristics of neonates with culture-proven bloodstream infection who have low levels of C-reactive protein (≦10 mg/L) // BMC Infect Dis. - 2015. - №2. - Р. 91-96.
- Masson S, Caironi P, Fanizza C, Thomae R, Bernasconi R, Noto A, et al. Circulating presepsin (soluble CD14 subtype) as a marker of host response in patients with severe sepsis or septic shock: data from the multicenter, randomized ALBIOS trial // Intensive Care Med. - 2015. - №41. - Р. 12-20.
- Endo S, Suzuki Y, Takahashi G, Shozushima T, Ishikura H, Murai A, et al. Usefulness of presepsin in the diagnosis of sepsis in a multicenter prospective study // J Infect Chemother. - 2012. - №18. - Р. 891-897.
- Endo S, Suzuki Y, Takahashi G, Shozushima T, Ishikura H, Murai A, et al. Presepsin as a powerful monitoring tool for the prognosis and treatment of sepsis: a multicenter prospective study // J Infect Chemother. - 2014. - №20.- Р. 30-34.
- Romualdo LG, Torrella PE, González MV, Sánchez RJ, Holgado AH, Freire AO, et al. Diagnostic accuracy of presepsin (soluble CD14 subtype) for prediction of bacteremia in patients with systemic inflammatory response syndrome in the Emergency Department. Clin Biochem 2014;47: 505-508. doi:10.1016/j.clinbiochem.2014.02.011
- Wu J, Hu L, Zhang G, Wu F, He T. Accuracy of Presepsin in Sepsis Diagnosis: A Systematic Review and Meta-Analysis // PLoS One. - 2015. - №10. - Р. 133-157.
- Pugni L, Pietrasanta C, Milani S et al. Presepsin (Soluble CD14 Subtype): Reference Ranges of a New Sepsis Marker in Term and Preterm Neonates // PLoS One. - 2015. - №10(12). - Р. 45-51.
- Кольде Г. — Ю., Томэ Р. Становление пресепсина как нового биомаркера для диагностики и мониторинга неонатального сепсиса // Лаборатория. Журнал для врачей. - 2015. - №2. - С. 3-6.
- Козлова Е. М., Шунькина Г. Л., Чумак Н.М и др. Уровень пресепсина ликвора у новорожденных детей // Лаборатория. - 2014. - №2. - С. 3-12.
- Watson RS, Carcillo JA. Scope and epidemiology of pediatric sepsis // Pediatr Crit Care Med. - 2005. - №6. - Р.3-5.
- Stoll BJ,Hansen N. Infections in VLBW infants: studies from the NICHD Neonatal Research NETWORK // Semin Perinatol. - 2003. - №27(4). - Р. 293-301.
- Simonsen KA, Anderson-Berry Al, Delair SF et al. Early-onset neonatal sepsis // Clin Microbial Rev. - 2014. - 27(1). - Р. 21-47