Грибковые инфекции не щадят ни младенцев, ни лиц пожилого возраста. По данным ВОЗ, каждый пятый житель нашей планеты страдает каким-либо грибковым заболеванием, а также частота таких заболеваний по всему миру составляет 20-70% всего населения, и еще за последние 15 лет в США смертность от различных грибковых заболеваний увеличилась в 10 раз. С каждым днем число таких больных, невзирая на очевидные успехи и достижения медицины, значительно увеличивается. Последние оценки показывают, что во всем мире более чем 300 миллионов человек страдают от серьезных грибковых инфекций, из них наиболее распространенными и опасными для жизни инвазивными микозами являются: криптококкоз, кандидоз, аспергиллез, и пневмоцистоз (1, 2). Использовался теоретический метод исследования. Было проанализировано множество статьей американских ученых, в основе которых были различные книги, а также электронные журналы, такие как «Американское общество по микробиологии (ASM).
Актуальность.
Ежегодно серьезные грибковые инфекции становятся причиной 1,3 млн. смертей во всем мире. "Грибковые инфекции являются значительной причиной заболеваемости и смертности во всем мире и в настоящее время роль противогрибковых препаратов имеют свои недостатки. «Эти новые препараты могут проложить путь для развития нового класса противогрибковых препаратов», - сказал главный исследователь Маурицио дель Поэта, доктор медицинских наук, профессор на кафедре молекулярной генетики и микробиологии в Университете Стони Брук, Стоуни Брук, Нью-Йорк. Три класса противогрибковых препаратов в настоящее время доступны: азолы (например, флуконазол), полиены (например, амфотерицин В), и эхинокандины (например, каспофунгин). Тем не менее, эти препараты являются статическими и токсичными, имеют узкий спектр активности, а также взаимодействуют с другими препаратами, такими как химиотерапевтические агенты и иммунодепрессанты (3). Из-за ограниченного числа доступных противогрибковых на рынке, их широкое использование стимулирует развитие лекарственной устойчивости, и, таким образом, новые классы противогрибковых крайне необходимы (4, 5, 6, 7, 8, 9) . "Даже при лечении, смертность инвазивных грибковых инфекций составляет более 50%. Они являются токсичными, поэтому они влияют на другие органы, и они статичны, то есть они могут быть в состоянии остановить грибок размножение, но они не в состоянии убить грибок" сказал доктор Дель Поэта. Количество грибковых инфекций растет в части в связи с увеличением числа лиц, с иммунодефицитом заболеваний, таких как СПИД или тех, кто использует иммуносупрессивную лечение, например, некоторые методы лечения рака (10). Стали чаще регистрироваться глубокие, висцеральные микозы, порою ассоциированные с ВИЧ-инфекцией, онкогематологической патологией, пересадкой органов, выхаживанием новорожденных, при этом возрастает роль грибов, считавшихся ранее апатогенными. В настоящее время в список потенциальных возбудителей микозов включено около 400 видов грибов. Заболеванию микозами наиболее подвержены лица, лишенные иммунной защиты. Исследование было проведено многопрофильной группой исследователей в Университете Стони Брук, Медицинского университета Южной Каролины, Университета Цинциннати, Университета Техаса в Сан-Антонио, Университет Британской Колумбии, Вустер политехнического института, Медицинского колледжа Бэйлора, и Федеральный университет Рио де Жанейро (11).
Принципиально все грибковые заболевания делятся на две группы:
- поверхностные - микозы кожи, слизистых оболочек, волос и ногтевых пластинок
- глубокие - микозы внутренних органов (желудка, кишечника, суставов, легких, почек).
Грибы - это гетерогенная группа организмов, включая истинных миксомицетов (Mycomycetos, водяных плесеней Oomycota), настоящих грибов (Eumycota) и лишайников. Они объединяются в группу царство грибов (12). Грибы производят разные виды вторичных метаболитов, включая микотоксины и грибково-летучих органических соединений(VOCs). Микотоксины очень вредны как для людей, так и для животных (13, 14).
Грибы очень известны как причины заболевания кожных инфекции, аллергических и респираторных проблем (15). Кроме того медицинский институт (IOM) на основе английских литератур заявил, что именно грибы были тесно связаны с аллергией в помещениях, астмой и другими серьезными дыхательными заболеваниями (16, 17).
Заболевания, вызванные паразитическими грибками, называются микозами(18). Разновидностей микозов очень много, ведь в природе насчитывается несколько сотен способных паразитировать на нашем теле грибков.
Различают основные микозы кожи и ногтей — дерматомикозы (другие заимствованные из иностранного языка названия: дерматофитоз, дерматофития) и микозы внутренних органов. У животных могут также возникать отравления токсинами грибов, поражающих растительные корма, — микотоксикозы. Одними микозами болеют только люди или животные, другими человек заражается от животных (например, микроспорией).
Дерматомикоз- грибковое инфекционное заболевание, при котором может поражаться кожа, волосистая часть головы или ногти. Причиной дерматомикоза являются грибки- дерматофиты, принадлежащие к роду Microsporum, Trichoph yton и Epidermophyton. К примеру в Республике Казахстан число больных дерматомикозами за 5 лет увеличилось в 3,9 раза (19). По данным ДКГСЭН МЗ РК по Актюбинской области, в городе Актобе за 2013 год, точнее за 9 месяцев выявилось 87 случаев дерматомикозов, из них 41- трихофития, 46- микроспория, 93 % пациентов оказались детьми не достигшие 14 лет.
- По всему миру грибковые инфекции кожи, волос или ногтей влияют на~ 25% населения (~ 1,5 млрд) (20) и только в США амбулаторные посещения врачей составил 4М (21).
- Грибковая инфекция ногтей (онихомикоз) является общим заболеванием у взрослого населения, вероятно, 5- 25% с увеличением заболеваемости у пожилых людей (22, 23).
- Микоз (лишай стоп) более распространен, чем онихомикоз и более распространен у молодежи и у спортсменов.
- Инфекция Волос (опоясывающий лишай волосистой части головы) наиболее распространена среди детей, часто приводящих к залысине с психологическими последствиями. В недавнем американском обзоре, опоясывающий лишай волосистой части головы был найден у 6.6% населения с диапазонами от 0% до 19.4% (24), он более распространен в лишенных областях у темнокожих детей (25), и имеет глобальную распространенность в 200 миллионов случаев.
Грибковые инфекции известны как причины аллергических заболеваний (26) и были определены в качестве одних из основных бытовых аллергенов (27). Обычные или типичные внутренние формы грибов могут меняться в зависимости от изменения климата и географических месторасположении. Однако, уровень атипичной плесени увеличивается в помещениях из-за повторяющихся утечек воды, сырости, дома с высокой влажностью, а также повышается уровень распространенности аллергии и респираторных болезней (28, 29, 30). По данным американских ученных, был выявлены следующие данные распространенности аллергических грибковых заболевании:
Аллергический бронхолегочный аспергиллез (АБЛА)
- Во всем мире около у 4 миллионов человек развивается АБЛА, среди них 193 миллионов взрослых с активной астмой (31).
- У 15% людей с кистозным фиброзом развивается АБЛА, из них ~ 9000 случаев пострадавших.
Тяжелая астма с повышенной грибковой чувствительностью
- По прогнозам, это заболевание проявляется у 3.25-13 миллионов взрослых во всем мире, в зависимости от частоты тяжелой астмы (5-20% всех астматиков) (31).
Аллергический грибковый синусит.
- Аллергический грибковый синусит и ринит проявляется
у ~ 12 миллионов человек в любое время.
Аллергический ринит и синусит встречается у ~ 15% населения мира (32), или около у 900 миллионов человек, и ~ 1.3% преимущественно грибковые аллергии (33).
Сырость и плесень во многих эпидемологичесиких исследованиях показали дальнейшую связь с тяжелым кашлем и астмой (34, 35, 36). К видам найденных на мокрых строительных материалах, и связанные с аллергией и с заболеваниями дыхательных путей относятся : Alternaria, Aspergillus, Aureobasidium, Cladosporium, Fusarium, Paecilomyces, Phoma, Penicillium, Stachybotrys, Trichoderma (37, 38, 39).
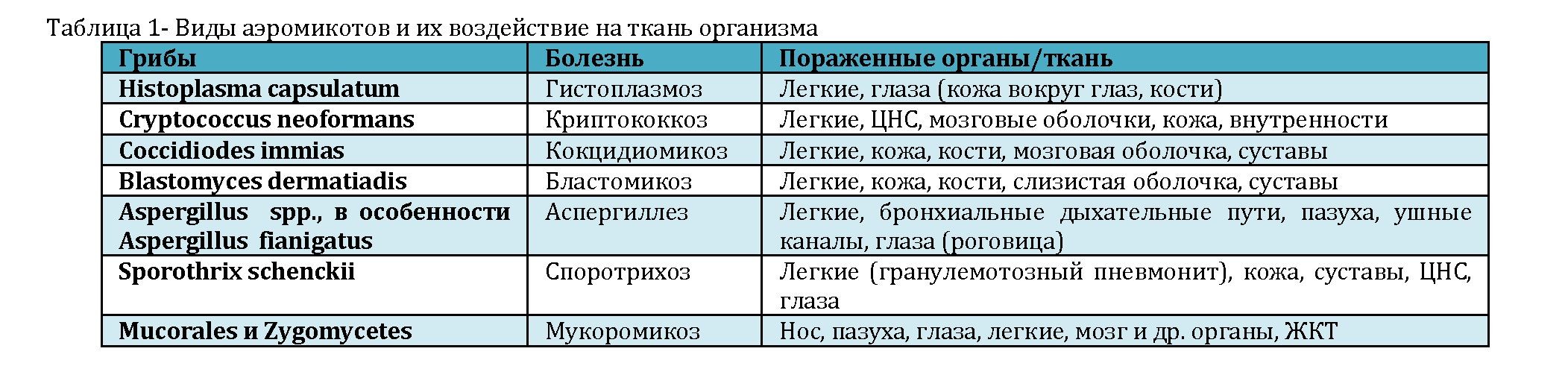
Исходя из материалов Chin S. Yang, E. Johanning “ Fungi and Mycotoxins” , в таблице 1 было указано основные виды грибов, и инфекции которые произошли путем воздушных передач и болезни, которые они вызывают, а также их клиническое проявление (40).
Агрессивный аспергиллез
- Каждый год приблизительно 10 миллионов пациентов в Европе, США и Японии подвергаются риску агрессивного аспергиллеза (АА), причиной которых явились кортикостероиды и другие методы лечения. Ежегодно более чем 50% пациентов с агрессивным аспергиллезом умирают, даже при наличии лечебных процедур.
- Ежегодно более чем у 200,000 пациентов развивается АА. Ключевые группы встречаются у ~10% острой лейкемии (300,000 новых случаев ежегодно) 12 (30,000 случаев АA) (41) пересадок стволовых клеток и других органов (75,000 ежегодно в США, Европе и Японии) (7,500 случаев АА) и 1.3% госпитализированных больных хронической обструктивной болезнью легких (42) (7% глобального числа умеренной и тяжелой хронической обструктивной болезни легких = 65M (60,000 подтвержденных и случаев АА).
Микотокисны.
Грибы могут вызывать заболевания людей различными способами. Во-первых, вследствие попадания в организм токсических продуктов обмена веществ — микотоксинов,. Во- вторых, вследствие попадания в дыхательную систему грибных спор, содержащих вещества (главным образом, белки), которые воздействуют на иммунную систему и вызывают аллергию.
Микотоксины (от греч. µúĸг∣ç mykes, mukos — «гриб»; τοξικ0ν, toxikon — «яд») — токсины, низкомолекулярные вторичные метаболиты, продуцируемые микроскопическими плесневы ми грибами, может вызвать серьезное заболевание или гибель людей, животных, а также рыб (43).
На основе общего согласия этот термин включает в себя токсины, производимые от больших грибов, а также соединение, которое вызывает заболевание только у организмов с ослабленным иммунитетом. Грибы вырабатывают огромное количество вторичных метаболитов. Конкретные микотоксины производятся только конкретными грибами, обычно только несколькими видами (44). Молекулярная структура микотоксинов широко меняется, таким образом их воздействие на здоровье человека и животных также широко варьируется: они могут быть нейротоксинами, тератогенами, нефротоксинами, нефротоксинами, гепатотоксинами, иммуносупрессивными препаратами или канцерогенами. Международное агентство по изучению рака (МАИР) оценил важность микотоксинов в соответствии с риском канцерогенности для человека (45). Многие грибы вторичных метаболитов токсичны, но лишь немногие из них имеют существенную роль в отношении безопасности продуктов (многие из них немного канцерогенны). Большинство ученых этот факт мало волнует, может потому что их токсичность ограничена в соответствии с видами, которые редко встречаются в продуктах. Как уверяет Miller, J.D., в своей статье «Fungi and mycotoxins in grains: implications for stored products research» главными микотоксинами в большинстве являются (46):
- афлатоксины,
- ахратоксины А,
- фумонизины,
- дезоксиниваленол,
- зераленол.
Таким образом, ccылаясь на таблицу 2, можно выделить основные 6 групп микотоксинов, которые являются наиболее опасными для здоровья людей и животных, и их токсический эффект на организм.
Таблица 2 - Развитие микотоксинов у людей
Афлатоксины
Афлатоксины являются высокотоксично-канцерогенными продуктами плесневых грибов. Это природные микотоксины, которые производятся плесневым грибком Aspergillus. Афлатоксины являются наиболее токсичными среди известных канцерогенных веществ. Развитие грибов и продуцирование афлатоксина наблюдается в орехах арахиса и арахисовой муке, реже — в злаковых культурах (пшеница, рожь, ячмень, кукуруза и мука из них), бобовых и масличных культурах, молоке, мясе, яйцах и др. Наиболее оптимальные условия для роста и развития грибов, продуцирующих афлатоксины, — температура 20—30 °С, влажность воздуха — 85—90 %. Афлатоксины имеют вероятность участия в 5 токсико-эффектов : острая токсичность; оказывают сильное токсическое воздействие на печень, а в высоких концентрациях могут привести к летальному исходу в течение нескольких суток из-за острого поражения клеток печени; вызывают печеночный некроз, приводя позже к циррозу печени, или карциноме печени; супрессия иммунной функции; вызывают задержку роста и развития у детей (45) .
Канцерогенное воздействие на печень.
Это острое заболевание, возникающее в результате приема большого количества афлатоксинов за короткий промежуток времени. Взрослые люди имеют достаточно высокую степень устойчивости к афлатоксину, поэтому прием внутрь большого количества афлатоксина «за раз» o6ычно приводит к поражению печени и нервной системы, но острое заболевание редко заканчивается летальным исходом. Однако, у детей прием внутрь большого количества афлатоксинов может привести к смерти, поскольку молодые организмы очень чувствительны к этим ядам. В Индии 1974 году вспышка гепатита было связано с употреблением кукурузы, производимых афлатоксинами: были идентифицированы 100 случаев, клиническими признаками которых являлись - желтуха, предшествовавшим кашлем, рвотой и анорексией, с асцитом и отеками в нижних конечностях(47).
Две вспышки афлатоксина были запечатлены в Кении 1981 и 2004 году. Сообщалось, что в последней вспышке обнаружили 317 случаев, из них 129 погибли (48).
Хроническое потребление афлатоксина обладает дополнительным эффектом и может привести к развитию рака печени. Афлатоксин увеличивает риск развития рака печени (обычно гепатоцеллюлярная карцинома или ГЦК) у всех людей, которые потребляют загрязненную еду. также он может увеличить риск рака легких у рабочих, кто обрабатывает зерно. Инфецирование вирусами гепатита В или С в сочетании с потреблением афлатоксина может увеличить риск развития рака печени более чем в 30 раз по сравнению с людьми, которые подверглись воздействию афлатоксина, но не инфицированы вирусом гепатита. МАИР признает, что Афлатоксин B1 является самым сильнодействующим, известным химическим веществом, вызывающим развитие рака печени. Это продукт грибов
Aspergillus flavus, который найден в продуктах, которые хранились в горячей и влажной среде. Эти грибы были обнаружены в таких пищевых продуктах как арахис, рис, соя, зерно и пшеница. Афлатоксин B1 подозревался в развитии рака печени в Южном Китае и Африке (Сахара). Полагают, что он вызывает рак, производя замены (мутации) в гене p53. Эти мутации работают посредством взаимодействия с важными функциями гена в подавлении (ингибировании) опухолевого роста (49).
Цирроз печени
Прямых доказательств, что афлатоксины являются причиной цирроза печени ограничена, но тем не менее гибель от цирроза печени - является главной причиной смертности. При длительном воздействии небольших доз развивается цирроз печени. Афлатоксины - самые сильные яды, обладающие поражающим печень действием.
Задержка роста и развития у детей
Высокий уровень или хроническое воздействия афлатоксина может вызвать острую печеночную недостаточность, проявляющуюся кровотечением, отеками, изменениями в пищеварении, психическими изменениями или комой, это может стать причиной некроза печени, в результате чего позднее появляется цирроз или рак печени. Люди имеют высокую устойчивость к воздействию афлатоксина. Однако дети, особенно страдают от воздействия афлатоксина, что приводит к замедлению роста и задержки развития (50).
Иммуносупрессия
Афлатоксины обладают сильным иммунодепрессивным действием. Поэтому к факту заплесневения продуктов питания надо подходить осторожно. Простое механическое удаление плесеней еще не гарантирует безопасность, так как микотоксины способны диффундировать в глубь продуктов (сыров, фруктов). При низких концентрациях (20200 мкг/кг) афлатоксин снижает продуктивность и состояние здоровье. Потребление корма обычно снижается, вызывая депрессию интенсивности роста, а также супрессию иммунной функции. При высоких уровня (от 1000 мкг/кг и более) возможна смерть (49) .
Охратоксины
Охратоксин вырабатывается грибами родов Aspergillus и Penicillium. Они содержат остаток изокумарина, соединенный пептидной связью с L- аланином. Обладают выраженным нефротоксическим и тератогенным действием Охратоксин А (ОТА) является самым важным среди прочих охратоксинов, которые продуцируется некоторыми видами Aspergillus (ochraceus) и Penicillum (verrucosum), и является наиболее опасным для здоровья человека представителем данной группы. Канцерогенные свойства воздействуют очень широко, но сам механизм канцерогенности остается не совсем ясным (51, 52).
ОТА также является хроническим нефротоксином, который поражает функцию почек у всех протестированных животных. Он легко всасывается через кишечник, и как
|
Микотоксины |
Оценка МАИР |
Основной токсический эффект |
|
Афлатоксин B и G |
1 группа: канцерогенны для людей |
Канцероген, гепатотоксин, мутаген и тератоген |
|
Афлатоксин М1 |
2 группа В1: возможно канцерогенны для людей |
Канцероген, гепатотоксин, мутаген и тератоген |
|
Охратоксин А |
2 группа В2: возможно канцерогенны для людей |
Нефротоксин и тератоген |
|
Фумонизин |
2 группа В3: возможно канцерогенны для людей |
Нефротоксин, респираторные расстройства, нейротоксичность, вероятный канцероген |
|
Деоксиниваленол |
3 группа: не классифицируется как канцероген |
Нейротоксин |
|
Зераленол |
3 группа: не классифицируется как канцероген |
Вызывает нарушения генетического аппарата, мутаген |
только попадает в кровь, ОТА имеет длительный период полувыведения (53).
Фумонизины
Фумонизины представляют собой недавно открытую группу сходных по структуре токсичных метаболитов некоторых видов грибов. Главным их продуцентом является - Fusarium moniliforme, поражающий кукурузу во многих странах мира. Обширные исследования доказали связь потребления кормов и пищевых продуктов, зараженных фумонизинами, как с токсическими, так и с канцерогенными эффектами. Установлена связь между раком пищевода и фуманизиновым загрязнением кукурузы в тех регионах, где она составляет основу рациона, таких как Южная Африка (52, 54).
Согласно некоторым данным, фумонизины могут подавлять иммунитет и также негативно воздействовать на эмбрионы (в частности, вызывать дефекты нервной трубки). Кроме того этот вид микотоксинов признан потенциально канцерогенным для человека. В частности, такая закономерность обнаружена в некоторых частях Ирана, Южной Италии, Кении, в провинциях Китая, и в малой части Южной Америки (55). Многочисленные исследования показали, что антиоксиданты могут предотвратить некоторые из цитотоксических эффектов фумонизинов и других микотоксинов (56).
Дезоксиниваленол
Дезоксиниваленол (ДОН)- принадлежит к трихотеценовым токсинам типа В, и является широко распространенным трихотеценом. Его выделяют плесневые грибы Fusarium graminearum и F. сulmorum , развивающиеся в умеренном климате. ДОН может вызвать заболевание желудочнокишечного тракта и снизить иммунную систему у людей. Он также может вызвать серьезные проблемы у свиней и домашних животных. ДОН часто обнаруживается в корме вместе с зеараленоном и другими фузариевыми токсинами (57).
Дрожжевые грибы.
Среди дрожжей, которые являются патогенными для людей, Candida spp. занимает четвертое место среди наиболее распространенной причины инфекции кровотока у госпитализированных больных. Они вызывают широкий спектр заболеваний, начиная от поверхностных и до хронических дерматитов кожи, распространенных болезней слизистых оболочков, глубокие инвазивные инфекции, особенно среди пациентов со значительной иммунодепрессией (58).
Примерно 95-97% всех Candida связаны с инфекциями кровотока, причиной которые являются 5 видов кандид: Candida albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. kruzei. cryptococcus sp., Trichosporon sp., Geotrichum sp., Rhodotorula sp., Hansenula sp., и они остаются важными патогенами кровотока в ослабленном иммунитете человека (59, 60). Заболеваемость инвазивных инфекции Candida резко увеличилось в течение 1980-1990х годов. По результатам совета большого эпидемиологического исследования внутрибольничной инфекции кровотока, происходивших в период между 1995-2002 г. в 49 больницах США, Candida spp. стал причиной внутрибольничных инфекции кровотока, и занял четвертое место, а среди единичных больных интенсивной терапии он занял третье место (61).
На основе проекта, активного наблюдения населения среди городов и стран, который был проведен в период между 1998-2000 г. в Коннектикут и Балтиморе, сообщилось что средняя ежегодная заболеваемость Кандидами было обнаружено 10 случаев на 100,000 человек, 28% из этих кандидемии имели свое начало в амбулаторных условиях. По всему миру, C.albicans продолжает оставаться наиболее распространенной причиной инвазивного кандидоза, но данные наблюдения из программы ARTEMIS DISK показывают, что доля случаев инвазивного кандидоза в связи с C.albicans снизилось с 73,7 % в период 1997-1998 годов до 62,3 % в 2003 году (62).
Появление наиболее распространенных видов non-candida albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. kruzei, вероятно из-за множество ведущих факторов (например, степени иммунодепрессии, возраст и сопутствующих заболеваний) и использование противогрибковых агентов (63). По данным “Fungal research trust”, распространенность орофарингеального кандидоза, молочницы ротовой полости или кандидоза ротовой полости составляют следующие данные:
- По оценкам ВОЗ 2009 года- стоматит возникает у ~ 9,5 млн человек по всему мир, из них ~ 90% пациентов с ВИЧ / СПИД-ом (64) не принимающих, но нуждающихся в антиретровирусной терапии (65).
- Стоматит встречается также у нормально развивающихся младенцев, и людей, принимающих ингаляционные стероиды для лечения астмы после лучевой терапии головы и шеи рака , а также у людей с зубными протезами, а у некоторых больных лейкемией и трансплантации органов.
- Кандидоз пищевода поражает приблизительно ~2 миллиона людей, из них ~20% больных ВИЧ/СПИД-ом (66) не на антиретровирусной терапии и ~0.5% на антиретровирусной терапии (67).
- Повторные приступы вульвовагинального эффекта ежегодно влияют на 75 миллионов женщин, у этих 5-8% женщин эти приступы обостряются по крайней мере 4 раза в год (68). Около 70% всех женщин, в какой-то момент их жизни, точнее в пременопаузе развивается молочница (69).
- Кандидемия развивается у населения со скоростью 2-11 / 100000 (70), у ~ 300 000 людей по всему миру, со смертностью 30-55%. Цифры выросли в США на 52% в период между 2000 и 2005 годах (71).
- Приблизительно 150,000 из 7.5 миллионов пациентов поступивших в отделение интенсивной терапии(ОИТ) в Европе, США и Япония каждый год проявляется Кандида в моче(в размере 2,7% в ОИТ ) (72), и частая находка у госпитализированных пациентов (73), а также с катетерами (~16%) 11 особенно у пациентов в ОИТ (74).
Что касается отечественных исследовании, к примеру: внутрибольничные инфекции (ВБИ), обусловленные грибами рода Candida, представляют собой актуальную и сложную проблему для современной медицины РК.По данным Республиканской санитарно-эпидемиологической станции Республики Казахстан, суммарный уровень заболеваемости ВБИ за 2003–2004 гг. составил 0,3–0,4 случая на 1000 госпитализированных больных. Частота инфекционно-воспалительных заболеваний у детей, обусловленных грибами рода Candida, достигает 15–30 % в общей этиологической структуре, а отдельные формы, такие как молочница, встречаются с частотой до 64,5 % в грудном возрасте (Г.А. Самсыгина, 2007). Ряд авторов (Г.А. Самсыгина, Г.Н. Буслаева и соавт., 1996) указывают на интенсивную циркуляцию Candida в стационарах, что выражается в высокой частоте носительства грибов среди персонала (до 45%), новорожденных детей (до 30%), инфицировании объектов окружающей среды (до 4%). Кандидозный стоматит обычно развивается как осложнение на фоне различных детских инфекционных заболеваний, гормональных нарушений, применения больших доз антибиотиков, которые значительно снижают иммунологическую реактивность организма. По данным Н.М. Блинер (1998), практически каждый третий ребенок, находящийся в стационаре, страдает той или иной формой кандидоза. В Республике Казахстан проблеме микозов при стоматологических заболеваниях посвящены работы Н.Б. Изенбаева, Т.К. Супиева, А.Л. Котовой (1996); Ш.С.Амировой, Л.Я.Зазулевской (2004); Н.М. Уразгалиевой, М.Т.Копбаевой (2006). Исследованиями С.А. Аханова (2004) установлено, что источниками внутрибольничных инфекций могут являться как сами больные, так и медицинский персонал стационара, являющийся носителем возбудителей, но не имеющий видимых клинических признаков болезни. Именно они представляют потенциальную эпидемиологическую опасность. Совместные исследования, проведенные в 26 странах мира, показали, что среди 14368 изолятов грибов Candida, выделенных от больных системными микозами в 40 госпитальных лабораториях, получены следующие виды: C.albicans– 69%, C.glabrata – 10 %, C.tropicalis – 4,2%, C.parapsilosis – 3,6%, C.krusei – 1,7% (С.А. Бурова, 2008). Среди детей с кандидозным стоматитом и кандидоносительством выявлена высокая распространенность кариеса зубов и его осложнений (95,0 %) с превалированием суб- и декомпенсированных форм. Заболевания тканей пародонта представлены острым катаральным гингивитом (45,3%), хроническим катаральным гингивитом (43,8%), хроническим гипертрофическим гингивитом (4,6%), локализованной формой хронического пародонтита (3,1%). Аномалии зубочелюстной системы составили 56,9 % (75).
Инфекции, вызванные криптококками (криптококкоз).
Среди всех инвазивных микозов криптококковая инфекция занимает одно из наиболее значимых мест, так как является жизнеугрожающим заболеванием. Криптококкоз - заболевание, вызываемое Cryptococcus spp., в подавляющем большинстве случаев - Cneoformans. Факторы риска: выраженные нарушения клеточного иммунитета, обусловленные СПИДом, лимфомой, хроническим лимфолейкозом, Т-клеточным лейкозом, реакцией "трансплантат против хозяина" при трансплантации органов и тканей, а также длительным применением глюкокортикоидов и иммуносупрессантов. Основными клиническими вариантами криптококкоза являются пневмония (заражение обычно происходит ингаляционным путем) и менингит. Криптококкоз был признан заболеванием человека начиная с конца 1800х и вначале 1990х годов (76). Cryptococcus gattii- является вторым наиболее распространенным видом Cryptococcus, связанным с заболеваниями людей и исторически являвшимся причиной инфекции у иммунокомпитентных и иммунодепрессивных лиц, проживающих в субтропических областях, таких как Австралия, Новая Зеландия, часть Азии, Африки (77). Другие виды Cryptococcus ,также имеют все большее признание, как причины инвазивных заболеваний у иммунодепрессивных пациентов. Cryptococcus Iaurentii является причиной инвазивных болезней у пациентов с раком (78), ВИЧ/СПИД-ом, первичным иммунодефицитом (79), а также и у пациентов, которые перенесли трансплантацию гемопоэтических стволовых клеток (80) . Одним из серьезных криптококковых инфекции является- криптококковый менингит. Он возникает при внедрении в мозговые оболочки дрожжевых грибков криптококков. Инфекция поражает в основном людей со значительно сниженным иммунитетом - это одно из самых частых осложнений у больных СПИДом, онкологических больных после курсов химио- и лучевой терапии и у больных на фоне подавления иммунитета при пересадке органов. Более чем 1 миллион людей заболевают криптококковым менингитом при наличии СПИДа, каждый год, приводя к ~600 000 смертельным случаям, из которых ~70% находятся в Африке, в районе Сахары (81).
Pichia
Среди всех видов аскомицетов, которые вызывают сложные инфекции у людей, наиболее распространенными считаются Pichia, pichia anomala ( прежде Hansenula anomala). Анаморфным видом является Candida pelliculosa, которая может находится в окружающей среде, а иногда может коллонизироваться в людях, и даже вызвать инфекцию поверхностной слизистой оболочки, которая похожа на другие инфекции Кандиды. Также были описаны причины Фунгемии, инфекции мочевых путей , эндокардита и пневмонии (82).
Было замечено несколько вспышек в педиатрической госпитали (83) у детских медсестер (84),и у педиатрических больных в ОИТ (85), а также и у взрослых (86). Pichia obmeri (телеморф C. guilliermondii)- второй наиболее распространенный вид Pichia, которая вызывает ослажненную инфекцию у людей. К таким инфекциям относятся: фунгемия(87, 88, 89, 90), эндокардит (91), флебит (92), перитонит (93), и инфекции мочевых путей (94). В дополнении Pichia fabianii может вызвать фунгемию у новорожденных (95), а также может быть причиной простатита (96).
Malassezia
Липофильные дрожжи рода Malassezia, обитающие на коже человека, обладают уникальными свойствами, особо выделяющими их из царства грибов. Уникальность состоит в том, что они представляют собой яркий пример способности микроорганизма в зависимости от условий окружающей среды и иммунитета хозяина проявлять свойства комменсала или патогена. Существует по крайне мере 11 видов Malassezia. Он в основном все чаще встречается в теплых краях, и может послужить причиной тяжелых кожных инфекции или может вызвать грибок инвазии глубокой ткани (97, 98, 99, 100, 101, 102, 103).
Sporobolomyces
Он является аморфным basidiomycetous. Sporobolomyces salmonicolor, Sporobolomyces holsaticus, Sporobolomyces roseuse- могут быть причиной таких болезней, как аллергические проявления, сложные инфекции, включающие в себя дерматит и эндофтальмит (104, 105).
И вот таким образом, можно сделать краткий анализ этих самых микробных агентов. В таблице 3 выделено основные представители дрожжевых грибов, их воздействие на организм человека, различные виды заболевания, а также их диагностика (Таблица 3).
Таблица 3 - Микробные агенты, вызывающие более серьезные или сложные желудочно-кишечные инфекции в ослабленным иммунитетом хозяина (по Iriving Nachamkin с соавт., 2009 (106))
|
Представитель грибов |
Объединение болезней |
Диагностический подход |
|
Candida spp. |
Рак ротоглотки, эзофагит |
Гистология , метод Грама |
|
Histoplasma capsulatum |
энтероколит, эзофагит |
Гистология, методы культивирования ,анализ мочевыводящих антигенов |
|
Pneumocystis |
Эзофагит в меньшей степени, внелегочный заболевание встречается редко |
Гистология, иммунофлюоресценция |
|
Cryptococcus neoformans |
Редко верхний и нижний отдел желудочно-кишечного заболевания |
Гистология, методы культивирования |
|
Aspergillus app. |
локализованная инфекция встречается редко, как правило, в контексте с диссеминированной заболеванием. |
Гистология, методы культивирования, |
|
Penicillium marneffei |
диарея |
Гистология, методы культивирования |
|
Zygomycetes (Rhizopus spp., Mucor spp., Rhizomucor, Cuninghamella, Absidia, Apophysomyces, Saksenaea spp., Conidiobolus spp., Basidiobolus spp.) |
верхний и нижний отдел желудочнокишечного заболевания |
Гистология, методы культивирования |
Исходя из всех зарубежных материалов, которые были нами собраны, исследования показали, что спектр инфекции вызванной различными видами грибов не является статичными, существуют четкие эпидемиологические тенденции в структуре грибных инфекции. Основополагающим фактором является общее увеличение количество восприимчивых пациентов. В настоящее время распространенной тенденцией является- появление внутренней противогрибковой лекарственной устойчивости или способность быстрой резистентности. Начиная с 50-60-х годов ХХ века отмечается постепенный неуклонный рост числа грибковых инфекций. По данным американской Системы надзора за нозокомиальными инфекциями (NNIS), в течение 10 лет, с 1980 по 1990 г., было отмечено увеличение числа грибковых инфекций с 2,0 до 3,8 на 1000 поступлений. Частота нозокомиальных грибковых инфекций мочевыводящих путей возросла с 9,0 до 20,5 на 10000 госпитализированных больных, частота хирургической раневой инфекции, вызываемой грибковыми микроорганизмами, увеличилась с 1,0 до 3,1 и частота фунгемии с 1,0 до 4,9 (107).
Насколько распространены грибковые заболевания? По данным “Fungal research trust”, опубликованным в 18 июня 2011 года, были известны некоторые данные:
Пневмоцистная пневмония
- • Все ~ 9,5 млн ВИЧ / СПИДом инфицированных пациентов (108), которые получают антиретровирусную терапию, подвергаются риску пневмоцитной пневмонии (PCP), а также многих других пациентов с ослабленным иммунитетом .
- В большинстве стран, признаны 60% новых видов СПИДа, и они развивают пневмоцистную пневмонию, со смертностью до 10-30% (109, 110).
- Точные оценки ежегодной заболеваемости трудно определить из-за недостатка диагностики, но число случаев по всему миру превышает в год более 200 000 больных.
Хронический грибковое заболевание
- Оценки глобального бремени хронического аспергиллеза превышает 3 миллиона, с ~ 1,1 млн случаев туберкулеза (111, 112, 113). Хронический аспергиллез легких усложняет многие респираторных заболеваний, включая туберкулез, АБЛА, саркоидоз и ХОБЛ.
- В США каждый год происходит между100000 и 300000 случаев кокцидиоидомикоза (114), а также и во многих регионах Центральной и Южной Америки.
- Как полагают ученые, были инфицированы до 50 миллионов человек с гистоплазмозом, с ~ 500 000 новых инфекций каждый год(115). Гистоплазмозные инфекции могут быть опасными для жизни у новорожденных и больных СПИДом, и распространяются в Центральной и Южной Америке.
Грибковые глазные инфекции
В Азии и Африке ежегодно около 1 млн. людей заболевают глазными инфекциями, которые были вызваны нитчатыми грибами, такие как Aspergillus и Fusarium. Среди причин слепоты помутнения роговицы (вызванными грибами или бактериями) составляет 10% от 284 миллионов человек с нарушениями зрения во всем мире (116).
СПИСОК ЛИТЕРАТУРЫ
- Brown GD, Denning DW, Gow NA, Levitz SM, Netea MG, White TC . 2012. Hidden killers: human fungal infections. Sci Transl Med 4:165rv13. doi:10.1126/scitranslmed.3004404.
- Tuite NL, Lacey K . 2013. Overview of invasive fungal infections. Methods Mol Biol 968:1-23. doi:10.1007/978-1-62703-257-5_1.
- Lepak AJ, Andes DR . 2015. Antifungal pharmacokinetics and pharmacodynamics. Cold Spring Harb Perspect Med 5:a019653. doi:10.1101/cshperspect.a019653.
- Rittershaus PC, Kechichian TB, Allegood JC, Merrill AH, Jr., Hennig M, Luberto C, Del Poeta M . 2006. Glucosylceramide syntha se is an essential regulator of pathogenicity of Cryptococcus neoformans. J Clin Invest 116:1651-1659. doi:10.1172/JCI27890.
- Singh A, Wang H, Silva LC, Na C, Prieto M, Futerman AH, Luberto C, Del Poeta M . 2012. Methylation of glycosylated sphingolipid modulates membrane lipid topography and pathogenicity of Cryptococcus neoformans. Cell Microbiol 14:500-516. doi:10.1111/j.1462- 5822.2011.01735.x.
- Oura T, Kajiwara S . 2010. Candida albicans sphingolipid C9-methyltransferase is involved in hyphal elongation.Microbiology 156:1234- 1243.doi:10.1099/mic.0.033985-0.
- Noble SM, French S, Kohn LA, Chen V, Johnson AD . 2010. Systematic screens of a Candida albicans homozygous deletion library decouple morphogenetic switching and pathogenicity. Nat Genet 42:590-598. doi:10.1038/ng.605.
- Levery SB, Momany M, Lindsey R, Toledo MS, Shayman JA, Fuller M, Brooks K, Doong RL, Straus AH, Takahashi HK . 2002. Disruption of the glucosylceramide biosynthetic pathway in Aspergillus nidulans and Aspergillus fumigatus by inhibitors of UDP-Glc:ceramide glucosyltransferase strongly affects spore germination, cell cycle, and hyphal growth. FEBS Lett 525:59-64. doi:10.1016/S0014- 5793(02)03067-3.
- Thevissen K, de Mello Tavares P, Xu D, Blankenship J, Vandenbosch D, Idkowiak-Baldys J, Govaert G, Bink A, Rozental S, de Groot PW, Davis TR, Kumamoto CA, Vargas G, Nimrichter L, Coenye T, Mitchell A, Roemer T, Hannun YA, Cammue BP . 2012. The plant defensin RsAFP2 induces cell wall stress, septin mislocalization and accumulation of ceramides in Candida albicans. Mol Microbiol 84:166-180. doi:10.1111/j.1365-2958.2012.08017.x.
- Morris AM . 2014. Review: voriconazole for prevention or treatment of invasive fungal infections in cancer with neutropenia. Ann Intern Med 161:JC8. doi:10.7326/0003-4819-161-2-201407150-02008.
- Julian E. Davies, University of British Columbia. Washington, D.C. - June 23, 2015. Identification of a New Class of Antifungals Targeting the Synthesis of Fungal Sphingolipids. found online at http://mbio.asm.org/content/6/3/e00647-15. Citation Mor V, Rella A, Farnoud AM, Singh A, Munshi M, Bryan A, Naseem S, Konopka JB, Ojima I, Bullesbach E, Ashbaugh A, Linke MJ, Cushion M, Collins M, Ananthula HK, Sallans L, Desai PB, Wiederhold NP, Fothergill AW, Kirkpatrick WR, Patterson T, Wong LH, Sinha S, Giaever G, Nislow C, Flaherty P, Pan X, Cesar GV, de Melo Tavares P, Frases S, Miranda K, Rodrigues ML, Luberto C, Nimrichter L, Del Poeta M. 2015. Identification of a new class of antifungals targeting the synthesis of fungal sphingolipids. mBio 6(3):e00647-15. doi:10.1128/mBio.00647-15.
- Fantry, L. 2000. Gastrointestinal infections in the immunocompromised host. Curr. Opin. Gastroenterol. 16:45.
- Caux, F., S. Aractingi, H. Baurmann, P. Reygagne, H. Dombret, S. Romand, L. Dubertret. 1993. Fusarium solani cutaneous infection in a neutropenic patient. Dermatology 186:232-235.
- Groll, A. H., T. J. Walsh. 2001.Uncommon opportunistic fungi: new nosocomial threats. Clin. Microbiol. Infect. 7:8-2
- Pfaller, M. A., and R. A. Fromtling. 1999. Mycology, p 1159-1326. In P. R. Murray, E. J. Baron, M. A. Pfaller, F. C. Tenover, R. H. Yolken, Manual of Clinicaal Microbiology, 7th ed, ASM Press, Washington, D. C.
- Institute of Medicine. 2000. Clearing the Air: Asthma and indoor Air Exposures. National Academy Press, Washington, D. C.
- Institute of Medicine. 2004. Damp indoor Spaces and Health National Academy Press, Washington, D. C.
- Kaplan, J. E., J. L. Jones, C. A. Dykewicz. 2000. Protists as opportunistic pathogens: public health impact in the 1990s and beyond. J. Eukaryot. Microbiol. 47: 15- 20.
- Егизбаев М.К., Тулепова Г.А., Султанбекова Г.Б. и др. Анализ заболеваемости заразно-кожными заболеваниями в ЮжноКазахстанской области Республики Казахстан // Успехи мед. микологии: Матер. IV Всерос. конгр. по мед. микологии. М., 2006. Т. 8. С. 9-10.
- Havlickova B, Czaika VA, Friedrich M. Epidemiological trends in skin mycoses worldwide. Mycoses. 2008 Sep;51 Suppl 4:2-15.
- Panackal AA, Halpern EF, Watson AJ. Cutaneous fungal infections in the United States: Analysis of the National Ambulatory Medical Care Survey (NAMCS) and National Hospital Ambulatory Medical Care Survey (NHAMCS), 1995-2004. Int J Dermatol. 2009 Jul;48(7):704-12.
- Pierard G. Onychomycosis and other superficial fungal infections of the foot in the elderly: a pan-European survey. Dermatology 2001;202:220-4.
- Thomas J, Jacobson GA, Narkowicz CK, Peterson GM, Burnet H, Sharpe C. Toenail onychomycosis: an important global disease burden. J Clin Pharm Ther. 2010 Oct;35(5):497-519.
- Abdel-Rahman SM, Farrand N, Schuenemann E, Stering TK, Preuett B, Magie R, Campbell A. The prevalence of infections with Trichophyton tonsurans in schoolchildren: the CAPITIS study. Pediatrics. 2010 May;125(5):966-73.
- Ali J, Yifru S, Woldeamanuel Y. Prevalence of tinea capitis and the causative agent among school children in Gondar, North West Ethiopia. Ethiop Med J. 2009 Oct;47(4):261-9.
- Chapman, J. A. 1999. Update on airbone mold and mold allergy. Allergy Asthma Proc. 20: 289-292.
- Burr, M. L. 1999. Indoor fungal exposure- does it matter and what can be done about it? Clin. Exp. Allergy. 29:1442- 1444.
- Burge , H. A. 1990. The fungi, p. 136-162. In P. Morey, J. Feely, and j. Otten, Biological Contaminants in Indoor Environments American Society for Testing and Materials, Philadelphia, Pa
- Burge , H. A. 1990. Bioaerosols : prevalence and health effects in the indoor environment. J. Allergy Clin. Immunol. 86:687-701.
- Storey, E., K. H. Dangman, P. Schenck, R> l. DeBernardo, C. S. Yang, A. Bracker, M. J. Hodgson. 30 Sep. 2004. University of Connecticut Health Center, Farmington, Conn, http://www.oehc.uchc.edu/clinser/MOLD%2-GUIDE.pdf
- Denning DW, Pleuvry A, Cole DC. Global burden of ABPA in adults with asthma and its complication chronic pulmonary aspergillosis. Manuscript submitted.
- Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet. 1998 Apr 25;351(9111):1225-32.
- Dall'Igna C, Palombini BC, Anselmi F, Araъjo E, Dall'Igna DP. Fungal rhinosinusitis in patients with chronic sinusal disease. Braz J Otorhinolaryngol. 2005 Nov-Dec;71(6):712-20.
- Bornehag, C. G., G., G. Blomquist, G. Gyntelberg, B. Jarvholm, P. Malmberg, L. Nordvall, G. Pershagen, J. Sundell. 2001. Dampness in buildings and health: Nordic interdisciplinary review of the scientific evidence on associations berween exposure to “dampness” in buildings and health effects. Indoor Air 11:72-86.
- Cox-Ganser, J. M., S. K. White, R. Jones, K. Hilsbos, E. Storey, P. L. Entright, C. Y. Rao, K. Kreiss. 2005. Respiratory morbidity in office workers in a water damagef building. Environ. Health Perspect. 113:485-490.
- Dangman, K. H., A. L. Bracker, E. Storey. 2005. Work-related asthma in teachers in Connecticut : association with chronic water damage and fungal growth in schools. Conn. Med. 69:9-17.
- Nielsen, K. F., K. Huttunen, A. Hyvarinen, B. Andersen, B. B. Jarvis, M.R. Hirvonen. 2002. Metabolite profiles of Stachybotrys isolates from water-damaged buildings and their induction of inflammatory mediators and cytoxity in macrophages. Mycopathologia 154:201-205.
- Nikulin, M. 1999. Toxigenic Stachybotrys chartarum in Water-Damaged Building Materials: Ecology and Biology. Microbiological publication 46/1999. University of Helsinki, Helsinki, Finland.
- Samson, R. A., J. Houbraken, R. C. Summenbell, B. Flannigan, J. D. Miller. 2001. Common and important species of fungi and actinomycetes in indoor environments, p. 287-473. Taylor&Francis, London, UK.
- Yang C, Johanning E. 2007. Airborne Fungi and Mycotoxins, p 972-988. In Hurst C, Crawford R, Garland J, Lipson D, Mills A, Stetzenbach L (ed), Manual of Environmental Microbiology, Third Edition. ASM Press, Washington, DC. doi: 10.1128/9781555815882.ch77.
- Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005 Mar-Apr;55(2):74-108.
- Guinea J, Torres-Narbona M, Gijón P, Muñoz P, Pozo F, Peláez T, de Miguel J, Bouza E. Pulmonary aspergillosis in patients with chronic obstructive pulmonary disease: incidence, risk factors, and outcome. Clin Microbiol Infect. 2010 Jul;16(7):870-7.
- Pitt, J.L. 1996. What are mycotoxins? Aust. VycotoxinNewsl. 7(4):1.
- Zhang. W. J., P.S. Fan, X.Zhang, C. J. Chen, and M. G. Zhou. 2009, Quantificationcof Fusarium graminearum in harvested grain by real-time polymerase chaun reaction to assess ifficacies of fungicides on Fusarium head blight, deoxynivalenol ontamination and yield of winter wheat. Phytopathology 99:95-100.
- Marta H. T. John I. Pitt. 2013 ASM Press, Washington, Food Microbiology, 4th Ed. Mycotoxins. 597-610
- Miller, J.D. 1995. Fungi and mycotoxins in grains: implications for stored products research. J. Stored Prod. Res. 31:1-16
- Azziz-Baumgartner, E., K. Lindblade, K. Gieseker, H. S. Rogers, S. Kieszak, H. Njapau, R. Schleicher, L. F. VcCoy, A. Misore, K. DeCochm C. Rubin, and L. Slutsker. 2005 . Case-control study of an acute aflatoxicosis outbreak, Kenya, 2004. Environ. Health Perspect. 113: 17791783.
- Lewis, L., M. Onsongo, H. Njapau, H. Schurz-Rogers, G. Luber, S. Kieszak, J. Nyamongo, J. Backer, A.M. Dahiye, A. Misore, K. DeCock, C. Rubin. 2005. Aflatoxin contamination of commercial maize products during an outbreak of acute aflatoxins in eastern and central Kenya, 2004. Environ. Health Perspect. 113:1763-1767.
- International Agency for Research on Cancer. 2002. IARC Monographs on the evalution of Carcinogenic Risks to Human, vol. 82. Some traditional Herbal medicines, Some Mycotoxins. International Agency for Research on Cancer, Lyon, France.
- Williams JH, Phillips TD, Jolly PE, Stiles JK, Jolly CM, Aggarwal D. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. The American Journal of Clinical Nutrition (2004). 80:1106-1122.
- Kuiper-Goodman, T., C. Hilts, S. V. Billiard, Y.Kiparissis, I. D. K. Richard, and S. Hayward. 2010. Health risk assesment of ochratoxin A for all age-sex strata in a market economy. Food Addit. Contam. Part A. Chem. Anal. Control Expo. 27:212-240
- World Health Organization. 2001. Safety Evalution of Certain Food Additives Series 47. World Health Organization, Geneva, Switzerland. World Health Organization. 2008. Safety Evalution of Certain Food Additives Series 59. World Health Organization, Geneva, Switzerland. Schaafsma, A. W., and D. C. Hooker. 2007. Climatic models to predict occurrence of Fusariom toxins in wheat and maize. Int. J. Food Microbiol. 119:116-125
- Sun, G., S. Wang, X. Hu, J. Su, T. Huang, J. Yu, L. Tang, W. Gao, J. S Wang. 2007. Fumonisin B1 contamination of home-grown corn in high- risk areas for esophageal and liver cancer in China. Food Addit. Contam. 24:181-185
- He, W., J. Kim, R. P. Sharma. 2004. Silymarin protects agents liver damage in BALB/c mice exposed to Fumonisin B1 despite increasing accumulation of free sphingoid bases. Tpxicol. Sci. 80:335-342.
- Bondy, G. S, J. J. Pestka. 200. Immunomodulation by fungal toxins. J. Toxicol. Environ. Health B 3:109-143.
- Pappas, P.G., J. H. Rex, J. Lee, R. J. Hamill, R. A. Larsen, W. Powderly, C.A. Kauffman, N. Hyslop, J. E. Mangino, S. Chapman, H. W. Horowitz, et al. 2003. A prospective observational study of candidemia: epidemiology, therapy, and influences on mortality in hospitalized adult and pediatric patients. Clin. Infect. Dis. 37:634-643.
- Nucci, M., K. A. Marr. 2005. Emerging fungal diseases. Clin. Infect. Dis. 41:521-526
- Phfaller, M. A., D. J. Diekema. 2004. Rare and emerging opportunistic fungal pathogens: concern for resistance beyond Candida albicans and Aspergillus fumigatus. J. Clin. Microbiol. 42:4419-4431
- Wisplinghoff, H., T. Bischoof, S. M. Tallent, H. Seifert, R. P. Wenzel, M. B. Edmond. 2004. Nosocomial bloodstream infectious in US hospitals: analysis of 24. 179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis. 39:309-317
- Hajjeh, R. A., A. N. Sofair, L. H. Harrison, G. M. Lyon, B. A. Arthington-Skaggs, S. A. Mirza, W. Lee-Yang, M. A. Ciblak, L.E. Benjamin, L.T. Sanza, S. Huie, S. F. Yeo, M. E. Brandt, D. W . Warnock. 2004. Incidence of bloodstream infections due to Candida species and in vitro sucseptibilities of isolates collected from 1998 to 200 in a population based active survillance program. J. Clin. Microviol. 42:1519-1527. Ngyuen, M. H., A. J. Morris, D. C. Tanner, M. L. Nguyen, M. M. Wagener, M. G. Rinaldi, V. L. Yu. 1996. The changing face of candidemia: emergence of non-Candida albicans species and antifungal resistance. Am. J. Med. 6:317-623.
- Matee MI, Scheutz F, Moshy J. Occurrence of oral lesions in relation to clinical and immunological status among HIV-infected adult Tanzanians. Oral Dis 2000;6:106-11.
- Towards universal access: scaling up priority HIV/AIDS interventions in the health sector Progress report, September 2010; Annex 3 - People (all age groups) receiving and needing antiretroviral therapy and coverage percentages, 2008–2009.
- Smith E, Orholm M. Trends and patterns of opportunistic diseases in Danish AIDS patients 1980-1990. Scand J Infect Dis. 1990;22(6):665-72.
- Buchacz K, Baker RK, Palella FJ Jr, Chmiel JS, Lichtenstein KA, Novak RM, Wood KC, Brooks JT; HOPS Investigators. AIDS-defining opportunistic illnesses in US patients, 1994-2007: a cohort study. AIDS. 2010 Jun 19;24(10):1549-59.
- Sobel JD. Vulvovaginal candidosis. Lancet. 2007 Jun 9;369(9577):1961-71.
- Ferre J. Vaginal candidosis: epidemiological and etiological factors. Int J Gynaecol Obstet 2000;71 Suppl 1:S21-7.
- Arendrup MC. Epidemiology of invasive candidiasis. Curr Opin Crit Care. 2010 Oct;16(5):445-52.
- Zilberberg MD, Shorr AF, Kollef MH. Secular trends in candidemia-related hospitalization in the United States, 2000-2005. Infect Control Hosp Epidemiol. 2008 Oct;29(10):978-80.
- Bougnoux ME. Candidemia and candiduria in critically ill patients admitted to intensive care units in France: incidence, molecular diversity, management, and outcome. Intensive Care Med 2008;34:292-9.
- Sobel JD, Fisher JF, Kauffman CA, Newman CA. Candida urinary tract infections--epidemiology. Clin Infect Dis. 2011 May;52 Suppl 6:S433-6.
- Bouza E, San Juan R, Munoz P, Voss A, Kluytmans J. A European perspective on nosocomial urinary tract infections II. Report on incidence, clinical characteristics, and outcome (ESGNI–004 study). European Study Group on nosocomial infection. Clin Microbiol Infect 2001;7:532-42.
- Каркимбаева Г. А . Профилактика и лечение кандидозных поражений слизистой оболочки полости рта у детей. - Алматы, 2010. – С.20.
- Perfect J. R., G. M. Cox2005. Cryptococcosis p. 637-658. In W> G> MERZ, R> J> Hay, Medical Mycology. Hodder Publishing, London, UK. Chayakulkeeree, M., J. R. Perfect. 2006. Cryptococcis. Infect. Dis. Clin. N. Am. 20:507-544
- Averbuch, D., T. Boekhout , R. Falk, D. Engelhard, m. Shapiro, C. Block, I. Polacheck. 2002. Fungemia in a cancer patient caused by fluconazole-resistant Cryptococcus laurentii. Med. Mycol. 40:479-484 .
- Simon, G., G. Simon, M. Erdos, M. Laszlo. 2005. Invasive Cryptococcus laurentii disease in a nyne-year-old boy with X-linked hyperimmunoglobulin M syndrome. Pediatr. Infect. J. 24:935-937.
- Krcmery, V. 1997. Nosocomial Cryptococcus laurentii fungemia in a bone marrow transplant patient after prophylaxis with ketoconazole successfully treated with oral flucanozole. Infection 25:130.
- Park BJ, Wannemuehler KA, Marston BJ, Govender N, Pappas PG, Chiller TM. Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS. AIDS. 2009 Feb 20;23(4):525-30.
- Burnik, C., N. D. Altintas, G. Ozkaya, T. Serter, Z. T. Selcuk, A. Topeli. 2007. Acute respiratory distress syndrome due to Cryptococcus albidus pneumonia: case report and rexiew pf the literature. Med. Mycol. 45:469-473.
- Chakrabarti, A., K. Singh, A. Narang, S. Singhi, R. Batra, K. L. Rao, P. Ray, S. Gopalan, S. Das, V. Gupta, A. K > Gupta, M. M. McNeil. 2001. Outbreak of Pichia anomala infections in the pediatric service of a tertiary-care center of northern India. J. Clin. Micrbial. 39:1702-1706.
- Arago, P. A., I. C. Oshiro, E. I. Mannique, C. C. Gomes, L. L. Matsuo, C. Leone, M. L. Moretti-Branchini, IRIS Study Group. 2001. Pichia anomala outbreak in a nursery : exogenous source? Pediatr Infect. Dis. J. 20: 843-848.
- Pasqualotto, a. C., T. C. T. Sukiennik, L. C. Severo, A. L. Colombo. 2005. An outbreak Pichia anomala fungemia in a Brazillian pediatric intensive care unit. Infect. Control Hosp. Epidemiol. 26:553-558.
- Kalenic, S., M. Jandrlic, V. Vegar, N. Zuech, A. Sekulic, E. Mlinaric-Missoni. 2001. Hansenula anomala outbreak at a surgical intensive care unit: a search for risk factors. Eur. J. Epidemiol. 17:491-496.
- Bergman, M. M., D. Gagnon, G. V. Doern,. 998. Pichia obmeri fungemia. Diagn. Mocrobiol. Infect. Dis. 30:229-231.
- Han, X. Y., J. J. Tarrand, E. Escudero. 2004. Infections by the yeasts Kondomaee (Pichia) obmeri: 2 cases and literature review . Eur. J. Clin. Microbiol. Infect. Dis. 23:127-130
- Ma, J. S., P. Y. Chen, C. H. Chen, C. S. Chi. 2000. Neonatal fungemia caused by Hansenula anomala: a case report. J. Microbial. Immunol. Infect. 33:267-270.
- Otag, F., N. Kuyucu, Z. Erturan, S. Sen, G. Emekdas, T. Sugita. 2005. An outbreak of Pichia obmeri infection in the pediatric intensive care unit: case reports and review on the literature. Mycoses. 48:265-269.
- Reina, J. P., D. H. Larone, J. R. Sabetta, K. K. Krieger, B. J. Hartman. 2002. Pichia obmeri prosthetic valve endocarditis and review of literature. Scand. J. Infect. Dis. 34:140-141.
- Schin, D. H., J. H. Park, J. H. Shin,S. P. Suh, D. W. Ryang, S. J, Kim. 2003. Pichia obmeri fungemia associated with phlebitis: successful treatment with amphotericin B. J. Infect. Chemother. 9:88-89.
- Choy, B. Y., S. S. Wong, T. M. Chan, K. N. Lai. 2000. Pichia obmeri peritonitis in a patient on CAPD: response to treatment with amphotericin. Perit. Dial. Int. 20:91.
- Puetro, J. L., P. Garcia-Martos, A. Saldarreage. 2002. First report of urinary tract infection due to Pichia obmeri. Eur. J. Clin. Microbiol. Infect. Dis. 21:630-631.
- Bhally , H. S., C. Shields, N. Halsey, E. Cristofalo, W. G. Merz. 2006. Infection of neonate caused by Pichia fabianii: importance of molecular identification. Med. Mycol. 44:185-187.
- Dooley, D. P., C>K> McAllister, B. S. Jefrey. 1990. Prostatitis caused by Hansenula fabianii. J. Infect. Dis. 161:1040-1041.
- №3-2015
- Aspiroz, C., M. Ara, M. Varea, A. Rezusta, C. Rubio. 2002. Isolation of Malassezia globosa and M. sympodialis from patients with pityriasis versicolor in Spain. Mycopathologia 154:11-117.
- Hazen , K. C., S. A. Howell. 2007. Candida Candida, Cryptococcus, and other yeast of medical importance, p. 1762-1788. In P.R. Murray, E. J. Baron, J. H. Jorgensen, M. N. Landry, and M. A. Pfaller, Manual of clinical Microbiology, 9th ed. ASM Press, Washington, DC.
- Hirai, A., R. Kano, k. Makimura, E. R. Duarte, J. S. Hamdan, M. A. Lazhance, A. Hasegawa. 2004. Malassezia nana sp.nov, a noval lipid dependent yeast species isolated from animals. Int. J. Syst. Evola. Microbiol. 54:623-627.
- Sugita, T., M. Tajima, M. Amaya, R. Tsuboi, and A. Nishikawa. 2004. Genotype analysis of Malassezia restricta as the major cutaneous flora in patients with atopic dermatitis and healthy subjects. Microbiol. Immunol. 45:755-759.
- Sugita, T., M. Tajima, M. Amaya, R. Tsuboi, and A. Nishikawa, M. Takashima. 2004. A new yeast, Malassezia yamatoensis, isolated from a patient with seborrheic dermatitis, and its distribution in patients and healty subjects. Microbiol. Immunol. 48:579-583.
- Sugita, T., M. Amaya, R. Tsuboi, and A. Nishikawa, M. Takashima, T. Skinoda, H. Suto, T. Unno. 2002. A new yeast species, Malassezia dermatis, isolated from patients with atopic dermatitis. J. Clin. Microbiol. 40:363-1367.
- Sugita, T., M, Takashima, M. Kodama, T., R. Tsuboi, and A. Nishikawa. 2003. Description of a new yeast species, Malassezia japonica, and its detection in patients with atopic dermatitis and healthy subjects. J. Clin. Microbiol. 41:4695-4699.
- Morris J. T.,cM. Beekius, C. K. McAllister. 1991. Sporobolomyces infection in an AIDS patient. J. Infect. Dis. 164:623-624.
- Morrow, J. D. 1994. Prosthetic cranioplasty infection due to Sporobolomyces J. Tenn. Med. Assoc. 87:466.
- Iriving Nachamkin. Ed by Randall T>H, Karen C. C, Donna M. Wolk. 2009. Diagnostic of the Immunocompromissed Host. ASM Press, Washington, DC.
- Anassie E, Bodey GP, Rolston K, et al. New spectrum of fungal infections in patients with cancer. - Rev Infect Dis 1989, 11: 369-378.
- Towards universal access: scaling up priority HIV/AIDS interventions in the health sector . Progress report, September 2010; Annex 3 - People (all age groups) receiving and needing antiretroviral therapy and coverage percentages, 2008-2009.
- Teshale EH, Hanson DL, Wolfe MI, Brooks JT, Kaplan JE, Bort Z, Sullivan PS; Adult and Adolescent Spectrum of HIV Disease Study Group. Reasons for lack of appropriate receipt of primary Pneumocystis jiroveci pneumonia prophylaxis among HIV-infected persons receiving treatment in the United States: 1994-2003. Clin Infect Dis. 2007 Mar 15;44(6):879-83.
- Walzer PD, Evans HE, Copas AJ, Edwards SG, Grant AD, Miller RF. Early predictors of mortality from Pneumocystis jirovecii pneumonia in HIV-infected patients: 1985-2006. Clin Infect Dis. 2008 Feb 15;46(4):625-33.
- Denning DW, Pleuvry A, Cole DC. Global burden of chronic pulmonary aspergillosis as a sequel to tuberculosis. Manuscript submitted.
- Smith N, Denning DW. Underlying pulmonary disease frequency in patients with chronic pulmonary aspergillosis. Eur Resp J 2011;37:865-72.
- Denning DW, Pleuvry A, Cole DC. Global burden of ABPA in adults with asthma and its complication chronic pulmonary aspergillosis. Manuscript submitted.
- Chiller TM, Galgiani JN, Stevens DA. Coccidioidomycosis. Infect Dis Clin North Am. 2003 Mar;17(1):41-57.
- Hammerman KJ, Powell KE, Tosh FE. The incidence of hospitalized cases of systemic mycotic infections. Sabouraudia. 1974 Mar;12(1):33-45.
- http://www.who.int/mediacentre/factsheets/fs282/en/index.html.