Первые представления о физиологической роли витамина D относятся к середине XVII века. Промышленная революция и массовая миграция населения в города привели к значительному росту заболеваемости рахитом среди детского населения. Патогенез рахита на тот момент оставался неясным, хотя было отмечено, что у детей из сельской местности, по сравнению с городскими жителями, он встречается реже. Предположение о том, что солнечный свет является важнейшим фактором в профилактике и лечении заболевания изначально не нашло поддержки среди практикующих врачей. Только в первой половине XIX века KHuldshinsky доказал, что облучение кварцевой лампой может являться эффективным способом терапии рахита. Практически одновременно с этим Е. Mel- lanby в экспериментах на собаках показал, что тяжелый рахит, вызванный рахитогенной диетой, излечивается рыбьим жиром. Автор предположил, что подобный эффект обусловлен наличием в нем какого-то витамина. Изначально исследователи полагали, что антирахитическое действие рыбьего жира обусловлено присутствием в нем витамина А. Однако в дальнейшем из трескового жира был выделен иной витамин, обладающий сильным антирахитическим действием – витамин D. В 1924 году A.Hess впервые получил холекальциферол из растительных масел после их облучения ультрафиолетовыми лучами с длиной волны 280-310 нм. Позднее, в 1937 году A.Windaus из 7-дегидрохолестерола впервые синтезировал витамин D3. В 60-80 годах XX века группа исследователей под руководством H.F.De Luca детально изучили метаболизм витамина D и описали все известные на тот момент его обменно-активные формы [1].
Известно, что витамин D поступает в организм человека двумя путями: с пищей и в результате синтеза в коже под влиянием ультрафиолетовых лучей. Витамин D довольно широко распространен в природе в виде провитамина D или стеролов, приобретающих свойства активного витамина под воздействием солнечного излучения. Различают несколько форм витамина D, основными из которых являются эргокальциферол (витамин D2) и холекальциферол (витамин D3). Наиболее богатыми источниками холекальциферола являются печень трески, тунца, рыбий жир, в меньшей степени – сливочное масло, яичный желток, молоко. Эргокальциферол содержится в продуктах растительного происхождения. Всасывание витамина D происходит, в основном, в двенадцатиперстной и тощей кишке в присутствии желчных кислот. Впоследствии он транспортируется лимфатической системой кишечника в виде хиломикронов, образующихся при взаимодействии холекальциферола с таурохолевой кислотой [2-5].
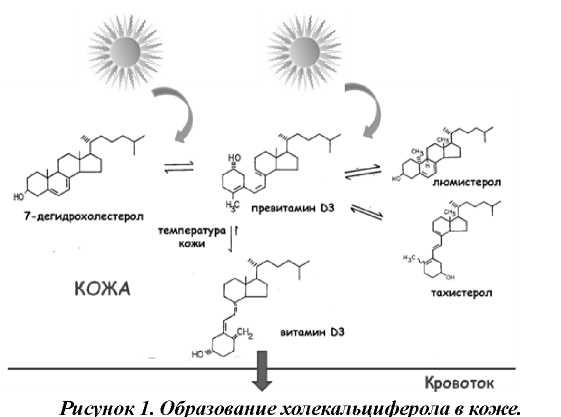
Фотосинтез витамина D в коже осуществляется в несколько этапов. Когда излучение длиной волны 280310 нм достигает поверхности кожи, около 90% его проникает в эпидермис и обеспечивает превращение 7-дегидрохолестерола (провитамина D3) в превитамин D3. Впоследствии превитамин D3 под влиянием температуры кожи превращается в холекальциферол (витамин D3) (рис. 1).
Следует отметить, что превитамин D3 чувствителен, как к тепловому, так и к ультрафиолетовому излучению (УФО). Прямая зависимость между продолжительностью УФО и содержанием превитамина D3 в эпидермисе отмечена только на начальных этапах его образования. При дальнейшем облучении кожи нарастания превитамина D3 (и соответственно, витамина D3) не происходит в виду его трансформации в биологически инертные изомеры (люмистерол, тахистерол). Сам витамин D3 также чувствителен к ультрафиолетовому излучению. Весь холекальциферол, который образовался в коже и не поступил в системную циркуляцию, при дальнейшем облучении также подвергается трансформации в неактивные соединения. Именно благодаря столь жесткой регуляции фотосинтеза, невозможно развитие гипервитаминоза D в результате продолжительного облучения солнечным светом [6-8].
Скорость фотосинтеза холекальциферола в коже составляет порядка 15-18 МЕ/см2/час, что позволяет большинству людей полностью удовлетворить потребность в нем за счет эндогенного синтеза в коже при адекватной инсоляции [9]. Однако следует учитывать, что на эффективность синтеза витамина D в коже человека существенное влияние оказывают климатические условия, географическая широта местности, уровень загрязненности воздуха, а также степень пигментации кожи.
В 1967 году Loomis выдвинул теорию о том, что кожная пигментация является фактором, регулирующим синтез витамина D3 в коже [10]. Он основывался на том, что люди, живущие вблизи экватора, могли бы умереть от интоксикации витамином D, ежедневно подвергаясь интенсивному солнечному излучению, если бы не выраженная пигментация кожных покровов. Впоследствии было показано, что меланин способен эффективно конкурировать с провитамином D3 за УФ-В фотоны, вследствие чего жители Африки и Азии нуждаются в более продолжительном ультрафиолетовом облучении, чтобы синтезировать количество витамина D3, аналогичное белокожему населению [11,12]. Возраст значительно влияет на способность кожи человека образовывать
витамин D3. Существует обратная зависимость между концентрацией провитамина D3 в эпидермисе и возрастом [13]. Образование превитамина D3 из 7-дегидрохолекальциферола также зависит от угла падения солнечного излучения, определяющего содержание УФ-В фотонов в солнечном спектре. Увеличение угла падения вследствие годового вращения Земли или изменения широты местности (удаления от экватора) определяет преобладание излучения с большей длиной волны. Как следствие, меньше УФ-В фотонов достигает поверхности кожи и стимулирует синтез витамина D, что необходимо учитывать в различных климатических зонах России. Фотофильтры, которые эффективно защищают кожу от повреждающего действия солнечного излучения, также уменьшают синтез витамина D3. Применение фильтра с фактором защиты 8 может полностью блокировать образование превитамина D3. При использовании данного фильтра после облучения всего тела человека дозой УФО, эквивалентной минимальной эритемной, не отмечается повышения концентрации витамина D3 в системной циркуляции [14].
Образовавшийся в коже и поступивший с хиломикронами лимфы из кишечника холекальциферол связывается со специфическим витамин D - связывающим белком, осуществляющим его транспортировку к местам дальнейшего метаболизма. Часть витамина D транспортируется в жировую и мышечную ткани, где он фиксируется,представляясобойрезервнуюформу.Основное же его количество переносится в печень, где происходит первый этап трансформации – гидроксилирование с образованием кальцидиола (25(ОН^). Образование кальцидиола катализирует 25-гидроксилаза, содержащаяся на внутренней мембране митохондрий печени [3,4,8]. Активность фермента сохраняется и при тяжелых хронических заболеваниях печени, сопровождающихся развитием печеночной недостаточности, что объясняется высоким компенсаторным потенциалом органа. Однако активность гидроксилазы может блокироваться некоторыми лекарственными препаратами, в частности, фенобарбиталом [1].
Кальцидиол – основная транспортная форма витамина D – является отражением D-витаминного статуса организма. Полупериод жизни кальцидиола в крови составляет 20-30 суток [3]. Столь длительная циркуляция метаболита в организме человека обусловлена высоким сродством 25(ОЩЭ3 D-связывающему белку. Циркулирующий комплекс кальцидиола с D-СБ, вероятно, захватывается клетками, после чего белок, имеющий более короткий полупериод жизни, разрушается, а 25(ОНр высвобождается в циркуляцию, где вновь связывается с D-связывающим белком [15]. Исследования показали, что активная инсоляция в летний период всего в течение нескольких часов обеспечивает образование достаточного уровня витамина D, который предотвращает развитие гиповитаминоза в течение нескольких месяцев [15].
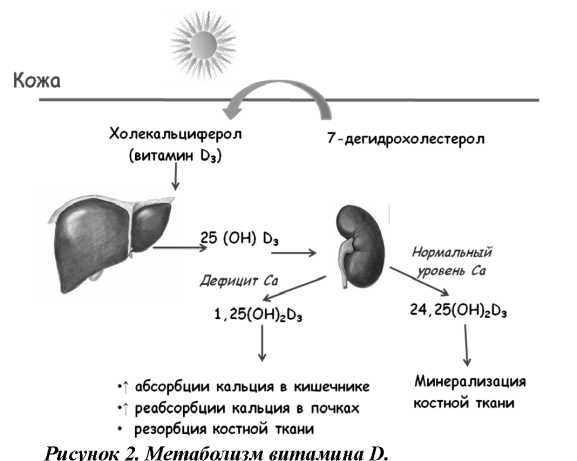
Образованный в печени 25-гидроксихолекальциферол переносится с помощью D-связывающего белка в почки, где в проксимальных извитых канальцах осуществляется второй этап его трансформации, приводящий к образованию гормонально активной формы витамина D - кальцитриола (1,25(ОН)^) или альтернативного метаболита 24,25(ОН)^. В условиях дефицита кальция и фосфора в организме метаболизм 25(ОН^3 идет по пути образования 1,25(ОН)^, основной эффект которого направлен на повышение сывороточной концентрации кальция путем усиления его абсорбции из кишечника и реабсорбции в почках, а также посредством резорбции кальция из костей. Процесс образования кальцитриола катализируется ферментом альфа-1-
гидроксилазой, присутствующей в митохондриях клеток почечных канальцев. При нормальной или повышенной концентрации кальция и фосфора в сыворотке крови нарастает активность фермента 24-гидроксилазы, под действием которой образуется альтернативный метаболит 25(ОН^3 – 24,25(ОН)^з, обеспечивающий фиксацию кальция и фосфора в костной ткани. (рис. 2).
Синтез 1,25-дигидроксихолекальциферола подвержен очень жесткой регуляции, благодаря чему образование 1,25(ОН)^3 происходит в соответствии с потребностью организма в кальции или кальцитриоле для функционирования других органов и тканей. Этим объясняется большая вариабельность содержания данного метаболита в сыворотке, не позволяющая использовать его в качестве показателя обеспеченности организма витамином D [4,16]. К основным факторам, обеспечивающим регуляцию синтеза 1,25(ОН^з, относятся паратиреоидный гормон, стимулирующий ренальную продукцию кальцитриола, уровень кальция и фосфора в сыворотке, а также концентрация самого метаболита в крови, способствующая снижению его продукции по механизму отрицательной обратной связи [17].
Паратиреоидный гормон, вырабатываемый паращитовидными железами в ответ на снижение кальция сыворотки крови, стимулирует синтез кальцитриола как непосредственно, путем активации альфа -1- гидроксилазы, так и опосредованно, угнетая активность 24-гидроксилазы, инактивирующей 1,25 (ОН)2 D3 [18]. Снижение сывороточного уровня кальция и фосфора также может стимулировать активность альфа- 1-гидроксилазы независимо от паратиреоидного гормона [19]. Было отмечено, что на активность 1-гидроксилазы влияет уровень эстрогенов [20]. Снижение уровня 1,25 (ОН)2 D3 в постменопаузе играет важную роль в развитии остеопороза. Проведение заместительной гормональной терапии эстрогенами восстанавливает нормальную активность фермента. Имеются данные, что в периоды активного роста, беременности и лактации соматотропный гормон и пролактин опосредованно оказывают влияние на продукцию кальцитриола, обеспечивающего возрастающую потребность организма в кальции [21,22]. Активность альфа-1- гидроксилазы снижается при развитии хронической почечной недостаточности в связи со снижением количества функционирующих нефронов. При этом трансплантация почки восстанавливает нормальный синтез кальцитриола. Следует отметить, что синтез кальцитриола не зависит от концентрации
25(ОН)¤3 за исключением периодов активного роста и восстановления дефицита витамина D, когда отмечается прямая зависимость между концентрациями обоих метаболитов [23].
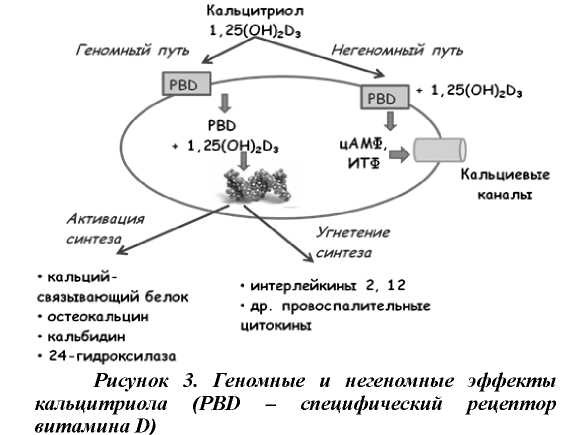
С момента активного изучения метаболизма витамина D накоплено достаточное количество данных, свидетельствующих о сходстве между наиболее активной формой витамина D - кальцитриолом и стероидными гормонами. Кальцитриол оказывает свое биологическое действие после связывания со специфическими рецепторами. Данный рецептор представляет собой белок с молекулярной массой 50 кДа, имеющий высокое сродство с 1,25(ОН)ɪÐ3. Холекальциферол и эргокальциферол в исходном состоянии не способны связываться с данным рецептором, а эффективность связывания 25(ОН) D3 составляет порядка 0,10,3% [24]. После взаимодействия с рецептором кальцитриол проходит через цитоплазматическую мембрану, избирательно связывается с регуляторными областями соответствующих генов. Результатом данного взаимодействия является активация синтеза одних белков (кальций-связывающий белок, остеокальцин, остеопонтин, кальбидин, спермин-связывающий белок, орнитинкарбоксилаза, 24-гидроксилаза) и угнетение образования других (в частности, интерлейкины -2, -12 и другие провоспалительные цитокины). Помимо геномного эффекта, кальцитриол обладает и негеномным действием на мембранные рецепторы, которые опосредуются синтезом вторичных мессенджеров (ц-АМФ, инозитолтрифосфат, арахидоновая кислота) [3,25] (рис. 3).
Витамин D, являясь важнейшим регулятором фосфорно-кальциевого метаболизма, обеспечивает необходимый уровень данных элементов для адекватного остеогенеза. В кишечнике кальцитриол осуществляет регуляцию абсорбции кальция после связывания со специфическими рецепторами клеток кишечного эпителия. В области щеточной каймы энтероцитов 1,25(ОН)^3 вызывает быстрое открытие кальциевых каналов и транспорт кальция в клетку. Данный процесс обуславливается негеномным эффектом кальцитриола и достигается в течение нескольких минут. Внутри клетки 1,25(ОН)^3 стимулирует образование кальций- связывающего белка, обеспечивающего направленный ток ионов кальция в сторону базолатеральной мембраны. Кальцитриол стимулирует активность АТФ-зависимого кальциевого насоса, транспортирующего Са++ из энтероцита в межклеточное пространство [26,27]. В кишечнике существует также пассивный транспорт кальция, осуществляемый путем его диффузии в области
РАЗДЕЛ I межклеточных контактов, однако существенной роли в поддержании кальциевого гомеостаза он не играет. В условиях достаточной обеспеченности организма холекальциферолом поступивший с продуктами питания кальций способен усваиваться на 30-40%, в то время как при недостатке витамина D его всасывание осуществляется всего на 10-15% [25]. Реализация эффекта кальцитриола в тонком кишечнике носит двухфазный характер и включает в себя первичную активацию абсорбции кальция в течение 6-18 часов и вторичное усиление его абсорбции в течение 24-48 часов. Ранний эффект достигается влиянием кальцитриола на энтероциты, находящиеся на вершине ворсинок, последующее действие опосредовано влиянием на крипты, где образуются энтероциты, мигрирующие к вершине ворсинок. В ходе ряда исследований на зрелых новорожденных крысах было показано, что эффект кальцитриола способен реализоваться только на 14-16 день от рождения животного, что объясняется нечувствительностью энтероцитов кишечника крысят к 1,25 (ОН)2 D3 в более ранние сроки. Эти данные опосредованно могут служить основанием для определения сроков назначения витамина D новорожденным детям [28].
В почках кальцитриол стимулирует реабсорбцию кальция и фосфора, что в совокупности с интестинальной абсорбцией элементов приводит к повышению их содержания в сыворотке до уровня, обеспечивающего адекватную минерализацию остеоида.
Новые сведения о механизмах резорбции костной ткани были получены с открытием новых членов семейства факторов некроза опухоли, их лигандов и рецепторов. RANK (receptor-activator of NF-kB) – рецептор-активатор нуклеарного фактора кВ – экспрессируется на поверхности клеток-предшественников остеокластов, дендритных клетках и является рецептором для RANKL. RANKL (receptor-activator of NF-kB-ligand) – трансмембранный лиганд рецептора-активатора нуклеарного фактора кВ – экспрессируется на поверхности остеобластов, стромальных клеток, а также активированных Т-лимфоцитов. Кальцитриол стимулирует остеобласты, что приводит к активации лиганда рецептора-активатора нуклеарного фактора кВ (RANKL); затем RANKL связывается с RANK на предшественниках остеокластов, индуцируя их дифференцировку и созревание и стимулируя остеокластогенез с последующей резорбцией кости. Эффект RANKL нейтрализуется остеопротегирином (OPG), который действует как «рецептор-ловушка» для RANKL. OPG-гликопептид широко представлен в различных тканях, обладает сильной ингибиторной активностью остеокластогенеза, т.е. является мощным ингибитором костной резорбции [29, 30].
Таким образом, под действием кальцитриола в кости идут два, с одной стороны разнонаправленных, с другой – взаимосвязанных процесса. Остеокласты осуществляют резорбцию костной ткани, обеспечивая повышение сывороточного уровня кальция и фосфора с последующим образованием гидроксиапатитов. В то же время, посредством активации соответствующих генов остеобластов 1,25(ОН)^3 усиливает синтез остеокальцина, остеопонтина, коллагена, необходимых для минерализации и функционирования вновь формирующейся кости.
В последние годы в ряде исследований показано, что холекальциферол способен регулировать не только фосфорно-кальциевый метаболизм и процессы минерализации костной ткани, но и оказывать влияние на функцию многих органов и систем организма. Специфические рецепторы к кальцитриолу обнаружены более чем в 30 различных органах и тканях, в частности, в коже, поперечно-полосатых и гладкомышечных волокнах, поджелудочной железе, органах репродуктивной и эндокринной систем, а также на клетках иммунной системы. Действие гормона, опосредованное данными рецепторами, направлено на регуляцию процессов пролиферации и дифференцировки клеток, синтеза гормонов, медиаторов воспалительных и иммунных реакций. Свое воздействие на вышеперечисленные процессы витамин Ð3 оказывает на уровне генома. Известно, что кальцитриол регулирует активность более чем 200 генов, ответственных за трансляцию соответствующих белков, участвующих в процессах метаболизма [24,25, 31].
Рецепторы к кальцитриолу выявлены в поперечнополосатых и гладкомышечных волокнах, кардиомиоцитах, кератиноцитах и фибробластах кожи, хондроцитах. Действие гормона, опосредованное данными рецепторами, направлено на регуляцию процессов роста и дифференцировки клеток в этих системах.
Имеются данные о нейропротекторном действии витамина Ð [3,32]. Было установлено, что последний способен проникать в мозг через гематоэнцефалический барьер и связываться с рецепторами витамина Ð3. Ядерные рецепторы к кальцитриолу обнаружены в нейронах мозга, глиальных клетках, а также в спинном мозге и периферической нервной системе. Нейропротекторное действие кальцитриола связано с подавлением уровня ионизированного кальция в мозге. Снижение уровня кальция осуществляется за счет образования кальций- связывающих белков (парвальбумина и кальбидинов D9k и D28k), а также путем ингибирования экспрессии кальциевых аналов L-типа в гиппокампе. В результате обоих процессов нейроны эффективно защищаются от токсического повреждения на фоне снижения уровня кальция в клетках. Кроме того, витамин Ð способен ингибировать фермент гамма-глутамилтранспептидазу, отвечающий за метаболизм глутатиона – важнейшего фактора антиоксидантной защиты нейронов. Усиливая антиоксидантную защиту мозга, кальцитриол вызывает снижение пероксида водорода и оказывает выраженное нейропротекторное действие.
В настоящее время большое внимание уделяется иммуномодулирующему и противовоспалительному эффектам кальцитриола. Открытие рецепторов к кальцитриолу на многих клетках иммунной системы, а также способности мононуклеарных фагоцитов к продукции 1,25 (ОН)2Ð3 явилось доказательством участия витамина Ð в функционировании иммунной системы [33]. Рецепторы к витамину Ð обнаружены на активированных Т-лимфоцитах, макрофагах. Максимальные их
концентрации отмечаются на незрелых лимфоцитах тимуса и зрелых CD8 клетках [34]. В-лимфоциты экспрессируют рецепторы к 1,25 (ОН)2Ð3 в незначительном количестве [35]. Кальцитриол ингибирует секрецию макрофагами ИЛ12 – цитокина, определяющего дифференцировку «наивных» Т-хелперов в Т-хелперы 1 типа [36]. За счет прямого воздействия на активированные Т-лимфоциты 1,25-дигидроксихолекальциферол уменьшает продукцию ими провоспалительных цитокинов – ИЛ2, ИФНу, ФHОα, ГМ-КСФ [37-39]. Кальцитриол способен ингибировать пролиферацию цитотоксических Т-лимфоцитов и естественных киллеров, а также стимулировать активность Т-супрессоров, поддерживая резистентность организма к собственным антигенам [33,40]. 1,25 (ОН)2Ð3 не оказывает непосредственного влияния на В-лимфоциты, однако, взаимодействуя с Т-хелперами, нивелирует их активирующее влияние на продукцию антител В-клетками [40]. Клинически иммуномодулирующее действие витамина Ð выражается в его способности в эксперименте предотвращать развитие и уменьшать выраженность клинических проявлений таких заболеваний, как рассеянный склероз, системная красная волчанка, сахарный диабет I типа, ревматоидный артрит [37,41]. Эффект кальцитриола при данных состояниях обусловлен действием гормона на составляющие реакций иммунного ответа, опосредованных Т-хелперами 1 типа [41].
Новые данные о физиологической роли витамина Ð в организме привели к изменению взглядов на него только как на типичный витамин. Несмотря на то, что многие аспекты метаболизма холекальциферола остаются до настоящего момента неизвестными, полученные результаты исследования влияния кальцитриола на многие системы организма открывают новые возможности применения активных метаболитов витамина Ð в терапии многих заболеваний.
списоК литератУры
- Захарова И.Н., Коровина Н.А., Боровик Т.Э., Дмитриева Ю.А. Рахит и гиповитаминоз D – новый взгляд на давно существующую проблему./Пособие для врачей. - Москва, 2011.-96 с.
- Коровина Н.А., Захарова И.Н., Дмитриева Ю.А. Современные представления о физиологической роли витамина D у здоровых и больных детей.// Педиатрия.- 2008.-т.87.-№4.- с.124-129
- Новиков П.В. Рахит и наследственные рахитоподобные заболевания у детей. М.:Триада-Х, 2006. – 336 c.;
- Adams ND, Garthwaite TL, Gray RW, Hagen TC, Lemann J. The interrelationship among prolactin, 1,25-dihy- droxyvitamin D3 and parathyroid hormone in humans. J Clin Endocrinol Metab 1979;49:628-30.
- Caniggia A, Lore F, di Cairano G, Nuti R. Main endocrine modulators of vitamin D hydroxylases in human pathophysiology. J Steroid Biochem. 1987;27(4-6):815-24.
- Cantorna MT, Mahon BD. D-hormone and the immune system. J Rheumatol Suppl. 2005 Sep;76:11-20.
- Cantorna MT, Zhu Y, Froicu M, Wittke A. Vitamin D status, 1,25-dihydroxyvitamin D3 and the immune system. Am J Clin Nutr. 2004; 80 (suppl): 1717S-1720S
- Christakos S., Dhawan P., Liu Y., Peng X., Porta A. New insights into the mechanisms of vitamin D action. J. Cell. Biochem. 2003;88:695–705;
- DeLuca H.F. Overview of general physiologic features and functions of vitamin D. Am. J. Clin. Nutr. 2004;80(Suppl.):1689S-1696S;
- DeLuca HF, Cantorna MT. Vitamin D: its role and uses in immunology. FASEB J. 2001 Dec;15(14):2579-85.
- DeLuca HF. Recent advances in our understanding of the vitamin D endocrine system. J Steroid Biochem. 1979 Jul;11(1A):35-52.
- DeLuca HF. Vitamin D-dependent calcium transport. Soc Gen Physiol Ser. 1985;39:159-76;
- Fraser DR. Physiology of vitamin D and calcium homeostasis. Rickets, ed.by Francis H. Glorieux, Nestle Nutrition Workshop Series, vol 21, 1991. p. 23-34
- Hayes CE, Nashold FE, Spach KM, Pedersen LB. The immunological functions of the vitamin D endocrine system. Cell Mol Biol (Noisy-le-grand). 2003 Mar;49(2):277-300.
- Henry HL. The 25-hydroxyvitamin D 1 . -hydroxylase. In: Feldman D, Pike JW, Glorieux FH, eds. Vitamin D. San Diego, CA: Elsevier Academic Press, 2005:69–83;
- Hofbauer LC, Heufelder AE. Role of receptor activator of nuclear factor-kappaB ligand and osteoprotegerin in bone cell biology. J Mol Med. 2001 Jun;79(5-6):243-53;
- Holick M.F. Resurrection of vitamin D deficiency and rickets. Clin. Invest. 2006; 116 (8): 2062—2072;
- Holick MF, Adams JS. Vitamin D metabolism and biological function. In: Avioli L, Krane SM, eds. Metabolic bone disease. 1990; 155-95.
- Holick MF, MacLaughlin JA, Doppelt SH. Factors that influence the cutaneous photosynthesis of previtamin D3. Science 1981;211:590-3.
- Holick MF. The vitamin D epidemic and its health consequences. J Nutr. 2005;135(11):2739S-2748S;
- Johnson JA, Kumar R. Renal and intestinal calcium transport: roles of vitamin D and vitamin D-dependent calcium binding proteins. Semin Nephrol. 1994 Mar;14(2):119-28;
- Kizaki M, Norman AW, Bishop JE, Lin CW, Karmakar A, Koeffler HP. 1,25-dihydroxyvitamin D3 receptor RNA: expression in hematopoetic cells. Blood. 1991 Mar 15;77(6):1238-47.
- Kumar R, Merimee TJ, Sliva P. The effect of chronic growth hormone excess or deficiency on plasma 1,25-dihy- droxyvitamin D3 levels in man. In: Norman AW, Schaefer K, von Herrath D, et al., eds. Vitamin D, basic research and its clinical application. New York: Walter de Gruyter, 1979;1005-9.
- Kumar R. Metabolism of 1,25-dihydroxyvitamin D3. Physiol Rev. 1984 Apr;64(2):478-504.
- Lemire JM. 1,25-dihydroxyvitamin D3 – a hormone with immunomodulatory properties. Z Rheumatol. 2000;59 Suppl 1:24-7.
- Lemire JM. Immunomodulatory role of 1,25-dihy- droxyvitamin D3. J Cell Biochem. 1992 May;49(1):26-31.
- Loomis F. Skin-pigment regulation of vitamin D biosynthesis in man. Science 1967;157:501-6.
- MacLaughlin J.A., Anderson R.R., Holick M.F. Spectral character of sunlight modulates photosynthesis of previtamin D3 and its photoisomers in human skin. . Science. 1982;216:13 001–1003;
- MacLaughlin JA et al. Spectral character of sunlight modulates photosynthesis of previtamin D3 and its photoisomers in human skin. Science 1982;216:1001-3
- MacLaughlin JA, Holick MF. Aging decreases the capacity of human skin to produce vitamin D3. J Clin Invest 1985;76:1536-8.
- Norman A.W. From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. American Journal of Clinical Nutrition, Vol. 88, No. 2, 491S-499S;
- Prentice A., Goldberg G.R., Schoenmakers I. Vitamin D across the lifestyle: physiology and biomarkers. Am. J. Clin. Nutr.2008;88:500S-506S;Webb AR, Engelson O. Calculated ultraviolet exposure levels for a healthy vitamin D status. Pho- tochem Photobiol. 2007;82(6):1697-1703
- Rausch-Fan X, Leutmezer F, Willheim M, Spittler A et al. regulation of cytokine production in human peripheral blood mononuclear cells and allergen-specific th cell clones by 1alpha,25-dihydroxyvitamin D3. Int Arch Allergy Immunol. 2002 May;128(1):33-41.
- Sivri S.K. Vitamin D metabolism. In Calcium and vitamin D metabolism ed. by A.Hasanoglu published by Danone Institute Turkey Association, 2010, p. 5-13;
- Smith EL, Holick MF. The skin: the site of vitamin D3 synthesis and a target tissue for its metabolite, 1,25-dihy- droxyvitamin D3. Steroids 1987;49:103-7;
- Stern PH, Taylor AB, Bell NH, Epstein S. Demonstration that circulating 1,25-dihydroxyvitamin D3 is loosely regulated in normal children. J Clin Invest 1981;68:1374-7.
- Thomasset M. Vitamin D and the immune system. Pathol Biol (Paris). 1994 Feb;42(2):163-72.
- Wada T, Nakashima T, Hiroshi N, Penninger JM. RANKL- RANK signaling in osteoclastogenesis and bone disease. Trends Mol Med. 2006 Jan;12(1):17-25. Epub 2005 Dec 13;
- Wasserman RH, Fullmer CS. On the molecular mechanism of intestinal calcium transport. Adv Exp Med Biol. 1989;249:45-65
- Казюлин А.Н. Витамин D. М.: ООО НТЦ АМТ, 2007, 74с.;
- Майданник В.Г. Рахит у детей: современные аспекты. Нежин. аспект-Полиграф. 2006. c. 21-22, 26-31.